Hitta på sidan
Diabetes – glukossänkande läkemedelsbehandling vid typ 2-diabetes
Nationellt kliniskt kunskapsstöd med regionala tillägg.
Diagnoskoder saknas
Diagnoskoder saknas
För närvarande är diagnoskoderna inte tillgängliga.
Omfattning av kunskapsstödet
Denna behandlingsriktlinje omfattar blodsockersänkande läkemedelsbehandling vid typ 2-diabetes hos vuxna personer. Riktlinjen är densamma för både primärvård och specialiserad vård.
Utvecklingen av kunskapsläget inom området glukossänkande läkemedel samt en skillnad i användning av dessa läkemedel har skapat ett behov av en nationell behandlingsriktlinje. Behandlingsriktlinjen ska ge ökade förutsättningar för likvärdighet i vården vid detta tillstånd. Utifrån detta behov skapades en tvärprofessionell nationell arbetsgrupp (NAG) med representation från Sveriges sex sjukvårdsregioner.
Arbetsgruppen har tagit hänsyn till nationella och internationella behandlingsprinciper samt i sitt arbete utgått i hög grad från den konsensusrapport som EASD/ADA publicerade 2022 samt även tagit rekommendationen från NICE 2022 i beaktande. Behandlingsriktlinjen innefattar inte utförlig rekommendation kring levnadsvanor, eller läkemedelsbehandling av andra riskfaktorer för att undvika diabeteskomplikationer.
[1][2]
Andra relaterade kunskapsstöd
Nationellt vårdprogram vid ohälsosamma levnadsvanor – prevention och behandling
Om hälsotillståndet
Förekomst
Prevalensen av typ 2-diabetes är cirka 6 % i befolkningen, med dubbelt så hög förekomst och tidigare insjuknande hos personer med ursprung från Mellanöstern samt delar av Afrika och Asien. Prevalensen stiger med ökande ålder. [3]
Orsaker
Typ 2-diabetes utvecklas till följd av obalans över tid mellan insulinkänslighet och insulinsekretion. Typ 2-diabetes är en progressiv kronisk sjukdom med olika grad av insulinresistens och nedsatt egen insulinproduktion, vilket den blodsockersänkande behandlingen bör anpassas efter. Den är dessutom en heterogen sjukdom som kräver individualiserad behandling.
Riskfaktorer
Ärftlighet, obesitas (BMI > 30), tidigare graviditetsdiabetes, hög ålder samt låg grad av fysisk aktivitet är de främsta riskfaktorerna för att utveckla typ 2-diabetes. Grav parodontit har också visat sig vara en markör för typ 2-diabetes.
Behandling
Behandlingsrekommendation (PDF)
Hälsosamma levnadsvanor med fysisk aktivitet, hälsosamt födointag, rökstopp och begränsning av alkoholintag utgör basen för behandling i kombination med läkemedel. Det minskar risken för diabeteskomplikationer och underlättar en god blodsockerkontroll. Hos personer med bukfetma leder viktminskning och ökad fysisk aktivitet till minskad insulinresistens och sänkta blodsockernivåer. Behandling av obstruktivt sömnapnésyndrom liksom god munhälsa leder ofta till bättre metabol kontroll.
Aterosklerosutveckling påverkas främst av högt blodtryck och höga LDL-nivåer, medan höga glukosnivåer främst påverkar utveckling av mikrovaskulära komplikationer. Vid nyupptäckt typ 2-diabetes hos personer utan känd hjärt-kärlsjukdom minskar risken för framtida makrovaskulära komplikationer om HbA1c kan fås ner till närapå normala nivåer.
HbA1c-mål
HbA1c-mål för diabetesbehandlingen anpassas efter patientens ålder, tillstånd och övriga sjukdomar, se tabell nedan. Generellt mål med HbA1c-styrd behandling är god livskvalitet och förebyggande av komplikationer. Det är självklart viktigt att behandla alla riskfaktorer.[4]
|
Patient |
HbA1c-mål |
Kommentar |
|
Generellt mål |
≤ 52 |
|
|
Nydiagnostiserad eller lång förväntad överlevnad |
< 48 |
|
|
Äldre personer med flera kroniska sjukdomar alternativt mild till måttlig demenssjukdom |
< 64 |
Överväg högre mål vid insulinbehandling eller vid annan risk för hypoglykemi |
|
Skör patient med kort förväntad överlevnad |
Använd inte HbA1c |
Undvik hypoglykemier och symtomgivande hyperglykemier |
|
|
|
(5)(6)(7)(8) |
Bedömning av HbA1c
HbA1c anger hur stor andel hemoglobin som har glukos bundet till sig och är i de flesta fall ett bra mått på hur det genomsnittliga blodsockret legat under de senaste 2–3 månaderna. Beakta falskt låga HbA1c-nivåer som förekommer till exempel då blodbildningen inte är i balans (exempelvis vid graviditet eller postoperativt), vid hemoglobinopatier eller triglyceridemi. [9]
Behandlingsval
Sammanfattning glukossänkande läkemedel
Etablerad kardiovaskulär sjukdom eller hög kardiovaskulär risk
Definitionerna av hög kardiovaskulär risk vid diabetes varierar men de flesta innefattar ålder 55 år eller äldre tillsammans med två eller flera av följande riskfaktorer: obesitas, hypertoni, rökning, dyslipidemi eller albuminuri. [5]
Diabetes innebär en förhöjd risk att insjukna och avlida av kardiovaskulär sjukdom. Utveckling av ateroskleros vid typ 2-diabetes beror dels på ökad förekomst av kardiovaskulära riskfaktorer som hypertoni, bukfetma och dyslipidemi, dels på långvarigt förhöjda insulinnivåer vid insulinresistens som stimulerar aterosklerosutvecklingen.
SGLT2-hämmare och GLP1-analoger
Sedan år 2008 är det obligatoriskt att i randomiserade studier undersöka kardiovaskulär säkerhet för glukossänkande läkemedel. Sedan dess har ett flertal studier på SGLT2*-hämmare och GLP1**-analoger visat på minskad kardiovaskulär risk vid typ 2-diabetes. Något av dessa läkemedel bör därför, om inte särskilda skäl föreligger, sättas in hos alla patienter med typ 2-diabetes och kardiovaskulär sjukdom. Samma rekommendation gäller vid hög kardiovaskulär risk i kombination med HbA1c över målvärde.
Vid hög kardiovaskulär risk och optimalt HbA1c är evidensläget oklart, men något av dessa läkemedel kan övervägas oavsett HbA1c-nivå, särskilt till personer med flera riskfaktorer. Välj av kostnadsskäl i första hand SGLT2-hämmare. Överväg GLP1-analoger före SGLT2-hämmare vid BMI > 35 där HbA1c-mål inte uppnåtts. [10][11]
* SGLT2 – Natriumglukostransportör 2
** GLP1 – Glukagonlik peptid-1-receptoranalog
Metformin
Metformin minskar risken för mikro- och makrovaskulära komplikationer hos patienter med övervikt och nydiagnostiserad typ 2-diabetes, jämfört med enbart kostrådgivning. Läkemedlet bör rekommenderas alla patienter med typ 2-diabetes, där det inte finns kontraindikationer.[12]
SGLT2-hämmare
Vid typ 2-diabetes och etablerad kardiovaskulär sjukdom eller hög riskprofil har SGLT2-hämmare stark dokumentation för att förebygga hjärtsvikt. SGLT2-hämmare har även bevisad nytta för behandling av hjärtsvikt, med och utan diabetes. SGLT2-hämmare bör erbjudas alla patienter med typ 2-diabetes och kardiovaskulär sjukdom samt övervägas vid hög kardiovaskulär risk.
[13][14][15]
SGLT2-hämmare har en vätskedrivande effekt, framför allt vid uttalad hyperglykemi, varför dosen av eventuella vätskedrivande läkemedel kan behöva reduceras.
GLP1-analoger
Vetenskapliga studier visar att GLP1-analoger i injektionsform, men inte peroralt, minskar risken för totalmortalitet samt kardiovaskulär död hos patienter med typ 2-diabetes och kardiovaskulär sjukdom eller hög risk för sådan. I motsats till SGLT2-hämmarna har således flera GLP1-analoger dokumentation på minskad risk för stroke, men inte på minskad risk för hjärtsvikt.
GLP1-analoger bör, om inte särskilda skäl föreligger, erbjudas alla patienter med typ 2-diabetes och kardiovaskulär sjukdom, där behandling med SGLT2-hämmare ej tolererats eller bedömts som olämplig.
Om HbA1C-målet inte nås med metformin och SGLT2-hämmare vid hög kardiovaskulär risk bör GLP1-analoger läggas till behandlingen.
Vid uttalad obesitas och kardiovaskulär sjukdom kan GLP1-analog erbjudas som förstahandsbehandling.[16][17][18][19]
Kronisk njursjukdom
Nedanstående riktlinjer grundar sig i huvudsak på rekommendationer från American diabetes association (ADA) och Kidney disease: Improving global outcomes (KDIGO). [20]
Kronisk njursjukdom (CKD) vid diabetes innebär en påtaglig risk för kardiovaskulär sjukdom, hjärtsvikt, ytterligare försämring av njurfunktionen och död. Diagnosen CKD grundar sig på förekomst av albumin i urinen eller en estimerad glomerulär filtration (GFR) på mindre än 60 ml/min/1,73 m² där andra orsaker, som till exempel hög ålder, inte kan förklara en sänkt njurfunktion.
Albuminuri är som regel det första tecknet på en begynnande njurpåverkan. Variabeln mäts som kvoten mellan albumin och kreatinin (ACR) i urin. Denna kvot ska normalt vara lägre än 3mg/mmol.
Förutom glukossänkning ska läkemedelsbehandling vid CKD ha en dokumenterad skyddande effekt mot kardiovaskulär sjukdom, progress av CKD, hjärtsvikt och för tidig död. Vissa läkemedel bör undvikas eller kräver dosanpassning vid sänkt GFR.
Framför allt vid albuminuri har ACE-hämmare och angiotensin II receptorblockerare (RAS-blockad) en väldokumenterad njurskyddande effekt. Om kaliumnivåerna så tillåter har tillägg av en icke-steroid mineralreceptorantagonist (MRA) visat en gynnsam effekt. Majoriteten av CKD-patienter bör dessutom behandlas med något statinpreparat.
Metformin
Metformin har en god glukossänkande effekt och rekommenderas till personer med typ 2-diabetes och CKD med GFR > 30. Substansen utsöndras renalt och dosen måste därför reduceras vid sänkt GFR och ska inte användas vid GFR < 30.
SGLT2-hämmare
SGLT2-hämmare har en måttlig blodsockersänkande effekt vid nedsatt njurfunktion men har visat sig minska risken för progress av CKD, hjärtsvikt och kardiovaskulär sjukdom hos patienter med CKD. Flertalet patienter med CKD bör därför behandlas med någon SGLT2-hämmare oavsett HbA1c-nivå. Den blodsockersänkande effekten avtar med sjunkande GFR och man avråder än så länge från insättning vid GFR < 20. Om patienten tolererar behandlingen väl finns det dock ingen anledning att avbryta den om GFR sjunker och blir lägre än 20.
Insättning av en SGLT2-hämmare åtföljs som regel av en lätt sänkning av GFR. Denna beror på förändrad renal hemodynamik vilken på sikt är gynnsam och den sannolika förklaringen till preparatens njurskyddande effekt.
GLP1-analoger
RAS-blockad, statiner, metformin och SGLT2-hämmare är basbehandling hos flertalet personer med typ 2-diabetes och CKD. Vid behov av ytterligare blodsockerreglering är en GLP1-analog att rekommendera. Läkemedel ur denna grupp har visat en gynnsam effekt på progression av CKD liksom kardiovaskulär sjukdom. Dulaglutid, liraglutid och semaglutid doseras oberoende av njurfunktion (se avsnittet Avancerad njursvikt nedan). [21]
DPP4-hämmare
Utöver att sänka blodsocker har DPP4*-hämmarna ingen specifik njurskyddande effekt. Linagliptin kan ges utan dosanpassning medan övriga DPP4-hämmare måste reduceras vid GFR < 45. Av kostnadsskäl är sitagliptin att föredra.
*DPP4 – dipeptidylpeptidas 4
Avancerad njursvikt (GFR < 30 ml/min/1,73 m²)
Vid denna funktionsnivå är metformin kontraindicerat. Njurarnas förmåga att eliminera insulin minskar. Samtidigt blir patienten mer insulinresistent. Nettoresultatet varierar men ofta får insulindoserna sänkas och läkemedel som ökar risken för hypoglykemi bör undvikas.
SGLT2-hämmarna har en blygsam blodsockersänkande effekt men njurskyddande egenskaper även vid denna funktionsnivå.
GLP1-analoger har en bra blodsockersänkande effekt men kräkningar, diarré och illamående är vanligt, vilket måste beaktas vid behandling av CKD-patienter med avancerad njursvikt där risken för malnutrition och hypoglykemier kan vara stor.
I Sverige är GLP1-analogerna inte godkända för användning vid dialyskrävande njursvikt. Off-label förekommer dock, speciellt till patienter där man eftersträvar god metabol kontroll och viktnedgång.
DPP4-hämmare kan användas vid alla nivåer av njursvikt.
Pioglitazone kan användas även vid avancerad njursvikt, men beakta risken för vätskeretention. Pioglitazone ska inte användas till dialyspatienter på grund av begränsad erfarenhet.
Efter njurtransplantation
Såväl steroider som tacrolimus ingår i den immunsuppressiva standardbehandlingen efter en njurtransplantation. Dessa läkemedel är diabetogena och ett behov av glukossänkande läkemedel är vanligt. Njurtransplanterade patienter har exkluderats från flertalet kliniska prövningar och vår kunskap om långtidseffekter etc är mycket begränsad. En njurtransplanterad patient når sällan ett normalt GFR vilket måste beaktas speciellt vid behandling med metformin. SGLT2-hämmarna ökar risken för urogenitala infektioner och i väntan på kliniska prövningar bör preparatet därför användas med försiktighet till immunsupprimerade transplantationspatienter.
Personer utan hög kardiovaskulär risk*
Metformin och stöd vid ohälsosamma levnadsvanor är förstahandsbehandling.
Vid val av blodsockersänkande behandling som tillägg till metformin bör man utöver samsjuklighet även ta ställning till om patienten har nytta av viktnedgång eller om man vill undvika en viktminskning (till exempel vid kakexi till följd av cancer eller annat katabolt tillstånd). [22][23][24]
*) Definitionerna av hög kardiovaskulär risk vid diabetes varierar men de flesta innefattar 55 år eller äldre tillsammans med två eller fler av följande riskfaktorer: obesitas, hypertoni, rökning, dyslipidemi eller albuminuri.
Glukossänkande läkemedel med viktreducerande effekt
Hos personer med obesitas minskar metformin risken för hjärtinfarkt och död och rekommenderas därför som första behandlingsalternativ [25]
Når man inte HbA1c-målen rekommenderas i första hand tillägg av SGLT2-hämmare. I andra hand kan GLP1-analoger övervägas. SGLT2-hämmare är billigare än GLP1-analoger och har samma kardiovaskulära skyddande effekt. [26]
Den viktminskande effekten är i genomsnitt högre för GLP1-analoger än för SGLT2-hämmare. Därför kan man vid uttalad obesitas överväga att i första hand använda GLP1-analoger med hög viktreducerande effekt som tillägg till metformin. Semaglutid har mycket hög viktreducerande effekt medan dulaglutid och liraglutid har hög viktreducerande effekt. Övriga GLP1-analoger och SGLT2-hämmare har intermediär viktreducerande effekt (se sammanfattning glukossänkande läkemedel). Vid utsättande av dessa preparat ökar risken för viktuppgång. [2][27][1][28]
När samsjuklighet med hjärt-kärlsjukdom, hjärtsvikt eller njursjukdom inte finns är rekommendationen att HbA1c bör sjunka mer än 5 mmol/mol på sex månader för SLGT2-hämmare respektive 10 mmol/mol för GLP1-analoger. Annars bör preparaten bytas ut till annan glukossänkande behandling.
Obesitaskirurgi kan övervägas om intervention av hälsosamma levnadsvanor och läkemedelsbehandling inte resulterar i viktnedgång. Kirurgi ökar chansen för remission framför allt hos personer med kortare diabetesduration (högst 5–8 år). Även om remission inte uppnås innebär metabol kirurgi ofta bättre metabol kontroll än läkemedelsbehandling (se Nationella riktlinjer för vård vid obesitas – Prioriteringsstöd till beslutsfattare och chefer 2023 (socialstyrelsen.se) [29][30][31]
Tirzepatid, en kombinerad GIP*- och GLP1-analog, är registrerat i Sverige men finns i skrivande stund inte på marknaden. Tirzepatidbehandling har visat mycket god effekt på HbA1c, samt en viktreduktion på 15–20 %. [32]
*) GIP= glukosberoende insulinotrop polypeptid
Glukossänkande läkemedel med viktneutral respektive viktökande effekt
För personer med typ 2-diabetes utan övervikt finns det inte några tydliga vetenskapliga data kring vilken behandling som bör rekommenderas som tillägg till metformin, som utgör basbehandlingen om kontraindikationer ej föreligger. Valet är individberoende och görs utifrån behov av glukossänkning, samsjuklighet och kontraindikationer. [33]
Hos normalviktiga eller underviktiga personer med typ 2-diabetes är det i valet av behandlingen angeläget att utesluta att det föreligger insulinbrist, liksom att ta hänsyn till om det föreligger malnutrition på grund av ålder eller annan sjukdom.
Hos personer med typ 2-diabetes med måttlig hyperglykemi, där man vill undvika hypoglykemi och viktuppgång kan DPP4-hämmare vara ett alternativ. Generika sitagliptin och vildagliptin finns nu på marknaden.
SGLT2-hämmare har en medelhög till hög glukossänkande effekt och kan användas till normalviktiga individer, men ska undvikas som glukossänkande behandling till sköra äldre, personer med kakexi eller dåligt nutritionellt intag, liksom till personer där insulinbrist misstänks. Beakta det förhållandevis höga priset (jämfört med övriga perorala diabetesläkemedel).
SU*-preparat respektive repaglinid har en hög glukossänkande effekt. Här bör risken för utdragen hypoglykemi tas i beaktande, framför allt vid SU-behandling till mer sköra individer. SU-preparat främjar också viktuppgång.
*) SU - Sylfonylureid
Pioglitazon har en hög glukossänkande effekt. Det kan leda till viss viktuppgång. Här bör en risk för försämring av hjärtsvikt och en viss ökad risk för frakturer tas i beaktande.[34]
Till personer med uttalad hyperglykemi i kombination med malnutrition är ofta insulin ett värdefullt alternativ. Se i övrigt avsnittet om insulinbehandling nedan.
GLP1-analoger bör inte användas om viktnedgång ska undvikas. Dessa preparat är därtill de diabetesläkemedel som i dag är dyrast på den svenska marknaden och bör i första hand ges till dem som har störst förväntad nytta av dem.
Kombination av läkemedelsbehandling
Efter längre duration av typ 2-diabetes och för patienter som inte når målvärde av HbA1c behöver flera blodsockersänkande läkemedel kombineras. Alla läkemedel kan kombineras förutom GLP1-analoger och DPP4-hämmare, eftersom dessa grupper har samma verkningsmekanism via inkretinsystemet. Kombination av repaglinid, sulfonylureid och insulin bör också undvikas på grund av risk för hypoglykemi.
För personer där man inte når HbA1c-målvärdet bör DPP4-hämmare sättas ut då de enbart sänker glukos i måttlig grad. Däremot är det rekommenderat att fortsätta med (eller sätta in) GLP1-analoger, SGLT2-hämmare eller pioglitazon vid samtidig insulinbehandling, eftersom det förbättrar den metabola kontrollen och patienten ofta klarar sig med lägre insulindoser.
Äldre multisjuka eller sköra
Vid stor samsjuklighet, behov av stödinsatser på grund av dålig autonomi eller kort återstående livslängd är fokus livskvalitet, god nutrition och säkerhet. HbA1c behöver inte följas. Riktade p-glukoskontroller vid behov där riktvärde är 6–15 mmol/l och lägre värden kan accepteras om patienten inte står på läkemedel med risk för hypoglykemi. Högre värden kan accepteras om patienten inte är katabol och går ner i vikt. Enstaka höga värden (> 20mmol/l) hos välmående patienter kan lämnas utan åtgärd.
Att kontinuerligt ifrågasätta pågående behandling är extra viktigt hos sköra individer för att undvika överbehandling och biverkningar.
Hypoglykemi ökar risken för fall och kan ge kognitiva störningar eller psykiska symtom. Undvik därför läkemedel med långvarig blodsockersänkande effekt, såsom sulfonylureidpreparat.
Även vid måttlig samsjuklighet där den förväntade återstående livslängden är begränsad, men inte kort, bör hypoglykemier och symtomgivande hyperglykemier undvikas. Det finns hos denna grupp skäl att följa HbA1c, som bör ligga under 64. Vid insulinbehandling kan man dock behöva godta HbA1c-värden i det övre intervallet.
DPP4-hämmare
DPP4-hämmare ger en måttligt blodsockersänkande effekt utan risk för hypoglykemier och kan användas vid terminal njursvikt.
Repaglinid
Repaglinid ger en kortvarig, måttligt blodsockersänkande effekt, men kan användas oberoende av njurfunktion. Preparatet är särskilt lämpligt för att sänka stigande postprandiella glukosvärden. Födointag i samband med medicinering bör dock säkerställas. Risken för hypoglykemi är kortvarig men ökar vid gravt nedsatt njurfunktion.
SGLT2-hämmare
På grund av biverkningsrisk rekommenderas inte SGLT2-hämmare som glukossänkande läkemedelsbehandling till sköra äldre, men det kan vara motiverat vid andra indikationer. Till multisjuka men inte sköra individer kan SGLT2-hämmare användas med försiktighet. Vid ökad risk för urogenitala infektioner avråds från SGLT2-hämmarbehandling
Vid intorkning, svår sjukdom eller svält ska SGLT2-hämmarbehandling pausas för att undvika insjuknande i normoglykem ketoacidos.
Metformin
Metformin kan vara riskfyllt till sköra äldre. En fördel med metformin är att det inte ger hypoglykemier, vilket dock bör balanseras mot risken för laktacidos orsakat av plötslig njurfunktionsnedsättning vid exempelvis intorkning.
Insulin
Överväg alltid tillägg av insulin om det behövs för att uppnå individuellt glukosmål, vid symtomgivande hyperglykemi, vid uttalad njursvikt eller hos katabola patienter. Behövs insulin bör i första hand medellångverkande (NPH) insulin i en- eller tvådos användas. Används endos kan det med fördel ges på förmiddagen. Byte till långverkande insulinanalog bör ske vid misstanke om nattliga hypoglykemier.
Använd kortverkande insulin och mixinsulin med försiktighet på grund av ökad risk för hypoglykemier.
Ta regelbundna blodsockerkurvor vid insulinbehandling.
Gravida med typ 2-diabetes
Alla kvinnor med typ 2-diabetes ska remitteras till specialistmödravård så snart graviditet konstaterats.
Insulin är säkert att använda vid graviditet.
Metformin kan användas under graviditet. Men även om inga allvarliga negativa effekter har konstaterats kan metformin påverka fostrets tillväxt, och den långsiktiga effekten på barnets hälsa är inte klarlagd.[35]
Säkerhetsdata för övriga blodsockersänkande läkemedel saknas och därför rekommenderas utsättning med byte till metformin och/eller insulin när graviditet är planerad eller påvisad, eftersom hyperglykemi i tidig graviditet är ogynnsamt.
Hyperglykemi vid kortisonbehandling
Hos tidigare obehandlad patient bör metformin och/eller insulin användas i första hand. Till patienter med pågående glukossänkande behandling bör tillägg av insulin övervägas.
NPH-insulin administreras samtidigt som kortison, vanligtvis på morgonen. Starta med 8–10 E och följ p-glukos vid lunch och kvällsmat och höj efter behov. Insulindosen styrs av p-glukos före middagen. Bibehåll pågående peroral behandling om inga kontraindikationer för denna föreligger. Om patienten redan har insulinbehandling krävs vanligen doshöjning, oftast till frukost och/eller lunch. Den insulindos som slutligen krävs är oförutsägbar. Ju högre kortisondos och ju mer insulinresistens patienten har, desto högre insulindos krävs. Nedtrappning av insulindoser måste göras fortlöpande då kortisondosen reduceras.
Blodsockersänkande behandling vid ramadan
Evidens kring behandling med glukossänkande läkemedel och fasta är generellt sparsam. ADA/EASD har 2020 publicerat konsensus kring diabetesbehandling under ramadan. [36][37]
Många patienter med typ 2-diabetes väljer att fasta under ramadan. Denna intermittenta form av fasta innebär att en större måltid intas efter solnedgång (iftar) och en mindre måltid innan gryningen (suhoor). Mellan soluppgång och solnedgång intas varken föda eller dryck. Blodsocker bör regelbundet monitoreras under ramadan, särskilt för personer som har insulin eller SU-preparat. Alla ska informeras om symtom på hypo- och hyperglykemi, uttorkning eller akut sjukdom.
Risk vid fasta med glukossänkande läkemedel
|
Risk vid fasta |
Kommentar |
|
Låg risk, kan välja att fasta |
|
|
Måttlig risk, fasta med försiktighet |
|
|
Hög risk, överväg att avstå fasta |
|
|
Mycket hög risk, rekommendera avstå fasta |
|
Dosändringar av glukossänkande läkemedel vid Ramadan — till personer med låg/måttlig risk
|
Läkemedel |
Justering och fördelning |
|
Metformin |
|
|
SGLT2-hämmare |
|
|
DPP4-hämmare |
|
|
Pioglitazon |
|
|
GLP1-analog |
|
|
Sulfonylurea/repaglinid |
|
Insulinbehandling
|
Läkemedel |
Justering och fördelning |
|
Lång-/medellångverkande insulin |
|
|
Mixinsulin |
|
|
Snabbverkande insulin |
|
Glukossänkande läkemedel – Verkningsmekanismer och biverkningar
Metformin
Metformin utövar sin glukossänkande effekt framför allt genom att minska glukosnybildningen i levern och genom att öka glukosupptaget i muskulaturen. Eftersom laktat är ett substrat för leverns glukosnybildning, kan alltför höga doser av metformin leda till laktatansamling med risk för den allvarliga biverkningen laktatacidos. [38][39]
Metformin utsöndras genom njurarna, och nedsatt njurfunktion är därför en stark riskfaktor för metforminassocierad laktatacidos, särskilt vid metformindoser över 2 gram per dygn. Vid måttligt nedsatt njurfunktion ska metformindosen därför reduceras, och vid uttalat nedsatt njurfunktion är metformin kontraindicerat. [40]
Det är viktigt att informera patienter om att göra tillfälligt uppehåll med metformin i händelse av magsjuka, hög feber eller andra sjukdomar som medför risk för uttorkning och njurpåverkan. Gastrointestinala biverkningar är vanliga men kan ofta undvikas med god information och långsam upptrappning. Metforminbehandling kan även leda till sänkta nivåer av vitamin B12.
SGLT2-hämmare
SGLT2-hämmare utövar sin glukossänkande effekt genom att blockera natrium-glukos-kotransportören SGLT2 (sodium-glucose cotransporter 2), vilket medför minskad reabsorption av glukos i proximala tubuli i njuren och ökad utsöndring av glukos i urinen.
SGLT2-hämmare förebygger kardiorenal sjukdom även hos personer med hjärt- och njursvikt som inte har diabetes, vilket sannolikt förklaras av andra verkningsmekanismer kopplade till minskad kardiell volymsbelastning och minskat intraglomerulärt filtrationstryck i njuren. [41]
Normoglykem ketoacidos, det vill säga ketonkroppsbildning som leder till metabol acidos trots normala eller endast lätt förhöjda plasmaglukosvärden, är en allvarlig biverkning som kan uppstå vid behandling med SGLT2-hämmare. Denna biverkning har beskrivits framför allt hos personer med typ 1-diabetes, och SGLT2-hämmare ska därför endast användas vid typ 2-diabetes. Risken för ketoacidos ökar också vid samtidig LCHF-kost. Risken för ketoacidos ökar vid sänkt plasmavolym på grund av ökning av katekolaminer, glukokortikoider och glukagon och därmed ökad ketonkroppsproduktion. [42]
Det är viktigt att informera patienter om att göra tillfälligt uppehåll med SGLT2-hämmare i händelse av magsjuka, hög feber eller andra sjukdomar som medför risk för ketoacidos. SGLT2-hämmare ska alltid sättas ut inför större kirurgiskt ingrepp.
På grund av ökad glukosuri medför behandling med SGLT2-hämmare ökad risk för genitala infektioner och urinvägsinfektioner.
GLP1-analoger och DPP4-hämmare
GLP1-analoger utövar sin glukossänkande effekt genom att stimulera receptorn till glukagonlik peptid (GLP), vilket medför ökad frisättning av insulin, minskad frisättning av glukagon, förlångsammad magsäckstömning och dämpad aptit.[43]
DPP4-hämmare hämmar enzymet dipeptidyl-peptidas 4 (DPP-4), varvid nedbrytning av kroppseget GLP minskar.
Gastrointestinala biverkningar är vanliga vid behandling med GLP1-analoger. Den glukossänkande effekten är svagare för DPP4-hämmarna än för GLP1-analogerna, men biverkningsprofilen är mer gynnsam för DPP4-hämmarna.
Viktnedgång ses ofta vid behandling med GLP1-analoger medan DPP-4-hämmarna är viktneutrala.
Sulfonylurea och repaglinid
Sulfonylurea (SU) utövar sin glukossänkande effekt på specifika receptorer i bukspottkörtelns betaceller, vilket stimulerar ökad insulinutsöndring. Repaglinid har liknande verkningsmekanism men kortare verkningstid. [44][45][46]
De viktigaste biverkningarna är hypoglykemi (vanligare av SU-preparaten än av repaglinid) som kan bli utdragen och kräva slutenvård. Både SU-preparat och repaglinid kan orsaka viktuppgång.
Pioglitazone
Pioglitazone hör till läkemedelsgruppen tiazolidindioner och utövar sin glukossänkande effekt genom att binda till och aktivera den nukleära receptorn PPARỿ (peroxisome proliferator-activated receptor gamma), varvid insulinresistensen minskar och det perifera glukosupptaget ökar. [47][34]
Vid uttalad insulinresistens brukar därför pioglitazone ha en god glukossänkande effekt. Användningen begränsas dock av risken för vätskeretention och hjärtsvikt. En ökad frakturrisk finns också beskriven
Insulin
Insulinbehandling ökar det perifera glukosupptaget och hämmar glukogenolysen i levern. Hypoglykemi och viktuppgång är de viktigaste biverkningarna.
Insulinbehandling vid typ 2-diabetes kan bli aktuellt:
- vid konstaterad eller misstänkt betacellssvikt
- då man inte når glukosmålen med övriga glukossänkande läkemedel
- under övergående period med symtomgivande hyperglykemi – då sätts NPH-insulin in till natten parallellt med förändring av ohälsosamma levnadsvanor och ökad peroral dos glukossänkande läkemedel, insulinet kan sedan fasas ut när glukosmålen är nådda
- under pågående kortisonbehandling – se separat avsnitt.
Som startdos av NPH-insulin brukar 0,1–0,2 E/kg kroppsvikt fungera bra. Insulin dosjusteras med 2–4 enheter 2–3 gånger i veckan utifrån fasteglukos. Vid ytterligare behov av blodsockersänkning eller vid höga postprandiella blodsockervärden kan man lägga till snabbverkande insulinanalog (insulin lispro/insulin aspart) till måltiderna, alternativ byta till mixinsulin i 2-dos.
Vid kortisonbehandling eller till sköra äldre bör NPH-insulin framför allt tas på morgonen.
Långverkande insulin glargin kan användas i stället för NPH-insulin vid nattliga hypoglykemier som kvarstår trots justerade insulindoser. Långverkande insulin degludek har inte visat några kliniska fördelar jämfört med insulin glargin. Insulin degludek är dessutom betydligt dyrare varför det inte rekommenderas som behandling till personer med typ 2-diabetes.
Utbildning av patienten i injektionsteknik, blodsockermätning, självtitrering av insulin och förebyggande samt behandling av hypoglykemi är av betydelse för god metabol kontroll och minskad hypoglykemirisk.
För flera insuliner finns billigare biosimilarer att välja jämfört med originalprodukterna.
GIP-/GLP1-analoger
Tirzepatid, en kombinerad GIP*- och GLP1-analog som är registrerad i Sverige men finns i skrivande stund inte på marknaden. Tirzepatidbehandling har visat mycket god effekt på HbA1c, samt en viktreduktion på 15–20 %. Verkningsmekanismen påminner om GLP1-analogernas, men denna grupp påverkar även GIP-receptorer. Precis som för GLP1-analoger är gastrointestinala biverkningar mycket vanligt förekommande.
*) GIP= glukosberoende insulinotrop polypeptid
[43]
Miljöpåverkan
De flesta blodsockersänkande läkemedel bedöms ha låg miljöbelastande effekt.
GLP1-analoger bedöms inte ha någon miljöpåverkan på grund av deras peptidstrukturer.
Glimepirid har mycket låg nedbrytningsgrad och risk för bioackumulering, framför allt ansamling i fisk finns. Repaglinid bedöms vara ett mindre miljöbelastande alternativ.
För pioglitazon saknas miljödata.
Läkemedel och miljö - Janusinfo
För vissa insuliner finns pennor för flergångsbruk vilket är mindre miljöbelastande jämfört med engångspennor.
Levnadsvanor
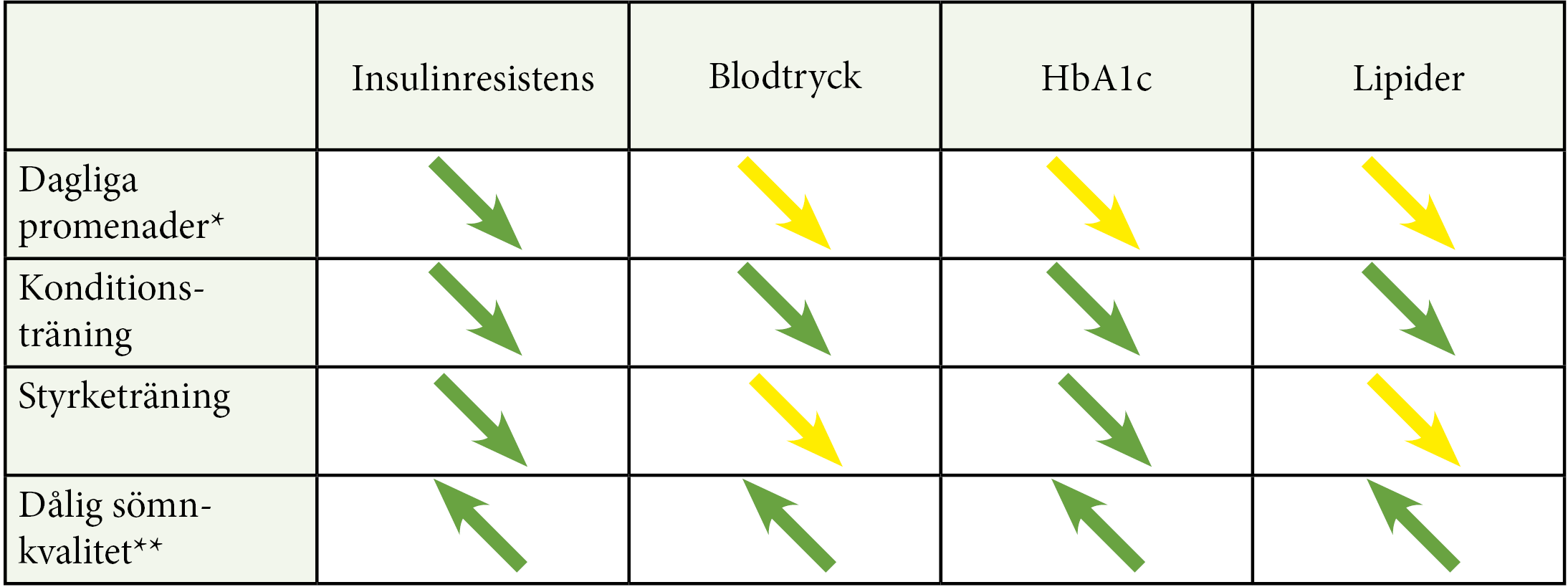
Levnadsvanor som påverkar metabol kontroll
|
|
Insulinresistens |
Blodtryck |
HbA1c |
Lipider |
|
Dagliga promenader* |
Sänker |
Sänker |
Sänker |
Sänker |
|
Konditionsträning |
Sänker |
Sänker |
Sänker |
Sänker |
|
Styrketräning |
Sänker |
Sänker |
Sänker |
Sänker |
|
Dålig sömnkvalitet** |
Höjer |
Höjer |
Höjer |
Höjer |
Levnadsvanor som påverkar metabol kontroll
Fysisk aktivitet och god sömnkvalitet minskar insulinresistens, HbA1c, blodtryck och LDL. (Gröna pilar = stark evidens; gula pilar = måttlig evidens)
Icke-farmakologisk behandling samt stöd vid ohälsosamma levnadsvanor är basen vid behandling av typ 2-diabetes och bör ingå som en naturlig del under hela sjukdomen.
Att förändra ohälsosamma levnadsvanor är ingen lätt uppgift och kräver en del av både patienten och diabetesteamet. Oftast är individen som mest förändringsbenägen vid tidpunkten för diagnos. Tät kontakt med diabetessjuksköterska, dietist och fysioterapeut kan behövas. Att utgå från personens egna levnadsvanor genom ett personcentrerat förhållningssätt och därifrån ge stöd till förändring kan hjälpa personen att genomföra sitt förändringsarbete.
Vid typ 2-diabetes har fysisk aktivitet i grupp visat sig vara effektivt. Att erbjuda patienter som röker stöd till rökstopp är självklart och bör prioriteras högt.
Enbart information/fakta kring goda levnadsvanor leder sällan till förändring.
De generella målen med nutritionsbehandling är
- att främja och stötta ett hälsosamt ätande för att generellt gynna hälsa
- att uppnå och bibehålla mål för kroppsvikt
- att uppnå individuellt satta mål för blodsocker, blodtryck och blodfetter
- att möta individuella nutritionsbehov
- att behålla matglädje
- att förse patienten med praktiska verktyg för måltidsplanering.
Uppföljning
Hos personer med typ 2-diabetes är det av stor betydelse att nå behandlingsmålen med avseende på HbA1c, blodtryck och lipider, i syfte att minska komplikationsrisken och öka chansen till att leva länge med god livskvalitet. Stöd till hälsosamma levnadsvanor, god kost och regelbunden motion och sömn tillhör grundläggande behandling.
Diabetes är en progressiv sjukdom som förändras över tid i sin karaktär. Det utmanar och ställer krav på val av farmakologisk behandling, kontinuitet och regelbunden uppföljning i syfte att nå behandlingsmål och minska utvecklingen av komplikationer.
Med stigande ålder ökar risken för sviktande insulinproduktion och samsjuklighet. Det innebär att den farmakologiska behandlingen måste anpassas, omvärderas och emellanåt ändras för att på bästa sätt ge skydd mot sjukdomsprogress och komplikationer.
Att utvärdera och ta hänsyn till ändrade förutsättningar såsom till exempel sviktande betacellsfunktion, biverkningar, njursvikt eller skörhet bör ske kontinuerligt.
Personer med typ 2-diabetes som uppnår behandlingsmålen bör i primärvården följas två gånger per år, med sex månaders intervall hos läkare respektive diabetessjuksköterska. [48]
Om behandlingsmålen inte uppnås rekommenderas tätare uppföljning, gärna kvartalsvis eller efter behov, då tiden kroppen utsätts för höga blodsockernivåer har betydelse för risken att utveckla diabeteskomplikationer.
HbA1c, kreatinin, U-Alb/krea-kvot, lipidstatus, vikt, EKG och blodtryck bör kontrolleras årligen oavsett vilken diabetesbehandling man har. Tätare kontroller får naturligtvis ske när patientens tillstånd eller läkemedelsbehandling så föranleder. Vid metforminbehandling bör även vitamin B12 kontrolleras regelbundet. Säkerställ också att regelbunden ögonbottenfotografering och fotstatus genomförs.
Patientmedverkan och kommunikation
Stöd och information för patient och närstående
Relaterad information
Kompletterande underlag
Konsekvensbeskrivning Glukossänkande läkemedelsbehandling vid typ 2-diabetes
Referenser
1. Davies MJ, Aroda VR, Collins BS, Gabbay RA, Green J, Maruthur NM, Rosas SE, Del Prato S, Mathieu C, Mingrone G, Rossing P, Tankova T, Tsapas A, Buse JB. Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2022 Dec;65(12):1925-1966. doi: 10.1007/s00125-022-05787-2. Epub 2022 Sep 24. PMID: 36151309; PMCID: PMC9510507.
2. NICE Guidelines: Type 2 diabetes in adults: management (update) Health economic model report. NICE Guideline Methods, evidence and recommendations February 2022. <a href="https://www.nice.org.uk/guidance/ng28/evidence/health-economic-model-report-pdf-10959500845" target="_blank" rel="noopener noreferrer">https://www.nice.org.uk/guidance/ng28/evidence/health-economic-model-report-pdf-10959500845</a>
3. Prevalence of diabetes among immigrants in the Nordic countries. Wändell PE, Carlsson A, Steiner KH.Curr Diabetes Rev. 2010 Mar;6(2):126-33. doi: 10.2174/157339910790909404.PMID: 20201798 Review
4. Referens: Rawshani A, Rawshani A, Franzén S, Sattar N, Eliasson B, Svensson AM, Zethelius B, Miftaraj M, McGuire DK, Rosengren A, Gudbjörnsdottir S. Risk Factors, Mortality, and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2018 Aug 16;379(7):633-644. doi: 10.1056/NEJMoa1800256. PMID: 30110583
5. Davies, M.J., et al., Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia, 2022. 65(12): p. 1925-1966
6. Matthew C. Riddle, Hertzel C. Gerstein, Rury R. Holman, Silvio E. Inzucchi, Bernard Zinman, Sophia Zoungas, William T. Cefalu; A1C Targets Should Be Personalized to Maximize Benefits While Limiting Risks. Diabetes Care 1 June 2018; 41 (6): 1121–1124. https://doi.org/10.2337/dci18-0018
7. Sinha, B., Ghosal, S. A Target HbA1c Between 7 and 7.7% Reduces Microvascular and Macrovascular Events in T2D Regardless of Duration of Diabetes: a Meta-Analysis of Randomized Controlled Trials. Diabetes Ther 12, 1661–1676 (2021). https://doi.org/10.1007/s13300-021-01062-6
8. Nuha A. ElSayed, Grazia Aleppo, Vanita R. Aroda, Raveendhara R. Bannuru, Florence M. Brown, Dennis Bruemmer, Billy S. Collins, Marisa E. Hilliard, Diana Isaacs, Eric L. Johnson, Scott Kahan, Kamlesh Khunti, Jose Leon, Sarah K. Lyons, Mary Lou Perry, Priya Prahalad, Richard E. Pratley, Jane Jeffrie Seley, Robert C. Stanton, Robert A. Gabbay; on behalf of the American Diabetes Association, 6. Glycemic Targets: Standards of Care in Diabetes—2023. Diabetes Care 1 January 2023; 46 (Supplement_1): S97–S110. https://doi.org/10.2337/dc23-S006
9. Jendle J, Landin B, Jansson S, Nordin G. När HbA1c inte stämmer. Läkartidningen. 2020,117:20001 https://lakartidningen.se/klinik-och-vetenskap-1/artiklar-1/klinisk-oversikt/2020/09/nar-hba1c-inte-stammer/
10. McGuire DK, Shih WJ, Cosentino F, et al. Association of SGLT2 Inhibitors With Cardiovascular and Kidney Outcomes in Patients With Type 2 Diabetes: A Meta-analysis. JAMA Cardiol. 2021;6(2):148-158
11. Sattar N, Lee MMY, Kristensen SL, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol. 2021;9(10):653-662
12. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998;352(9131):854-865
13. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015
14. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017;377(7):644-657
15. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019;380(4):347-357
16. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):311-322
17. Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016
18. Husain M, Birkenfeld AL, Donsmark M, et al. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2019;381(9):841-851
19. Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019;394(10193):121-130
20. de Boer IH, Khunti K, Sadusky T, Tuttle KR, Neumiller JJ, Rhee CM, Rosas SE, Rossing P, Bakris G. Diabetes management in chronic kidney disease: a consensus report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2022 Nov;102(5):974-989. doi: 10.1016/j.kint.2022.08.012. Epub 2022 Oct 3. PMID: 36202661
21. Kristensen SL, Rørth R, Jhund PS, Docherty KF, Sattar N, Preiss D, Køber L, Petrie MC, McMurray JJV. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol. 2019 Oct;7(10):776-785. doi: 10.1016/S2213-8587(19)30249-9. Epub 2019 Aug 14. Erratum in: Lancet Diabetes Endocrinol. 2020 Mar;8(3):e2. PMID: 31422062
22. Tilläggsbehandling med SGLT2-hämmare och GLP-1-receptoragonister hos patienter med typ 2-diabetes och risk för hjärt- och kärlsjukdom eller njursjukdom. SBU KOMMENTERAR RAPPORT 2022_07 PUBLICERAD: 19 MAJ 2022. https://www.sbu.se/2022_07?pub=92943
23. SBU. Tilläggsbehandling med SGLT2-hämmare och GLP-1- receptoragonister hos patienter med typ 2-diabetes och risk för hjärt- och kärlsjukdom eller njursjukdom <a href="https://www.sbu.se/pubreader/pdfview/display/92943?browserprint=1&lang=sv" target="_blank" rel="noopener noreferrer">https://www.sbu.se/pubreader/pdfview/display/92943?browserprint=1&lang=sv</a>
24. Palmer SC, Tendal B, Mustafa RA, Vandvik PO, Li S, Hao Q, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021;372:m4573. Available from: <a href="https://doi.org/10.1136/bmj.m4573" target="_blank" rel="noopener noreferrer">https://doi.org/10.1136/bmj.m4573</a>
25. Holman, R.R., et al., 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med, 2008. 359(15): p. 1577-89
26. Palmer SC, Tendal B, Mustafa RA, Vandvik PO, Li S, Hao Q, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021;372:m4573 Available from: <a href="https://doi.org/10.1136/bmj.m4573" target="_blank" rel="noopener noreferrer">https://doi.org/10.1136/bmj.m4573</a>
27. Pawaskar M, Bilir SP, Kowal S, Li Q, Weiss T, Davies G. Cost-effectiveness of intensification with SGLT2 inhibitors for type 2 diabetes. Am J Manag Care. 2021 Aug 1;27(8):e269-e277. doi: 10.37765/ajmc.2021.88728. PMID: 34460181
28. Lingvay I, Sumithran P, Cohen RV, le Roux CW. Obesity management as a primary treatment goal for type 2 diabetes: time to reframe the conversation. Lancet. 2022 Jan 22;399(10322):394-405. doi: 10.1016/S0140-6736(21)01919-X. Epub 2021 Sep 30. Erratum in: Lancet. 2022 Jan 22;399(10322):358. PMID: 34600604
29. Fultang J, Chinaka U, Rankin J, Bakhshi A, Ali A. Preoperative Bariatric Surgery Predictors of Type 2 Diabetes Remission. J Obes Metab Syndr. 2021 Jun 30;30(2):104-114. doi: 10.7570/jomes20084. PMID: 33436532; PMCID: PMC8277586
30. Khorgami Z, Shoar S, Saber AA, Howard CA, Danaei G, Sclabas GM. Outcomes of Bariatric Surgery Versus Medical Management for Type 2 Diabetes Mellitus: a Meta-Analysis of Randomized Controlled Trials. Obes Surg. 2019 Mar;29(3):964-974. doi: 10.1007/s11695-018-3552-x. PMID: 30402804
31. Mingrone G, Panunzi S, De Gaetano A, Guidone C, Iaconelli A, Capristo E, Chamseddine G, Bornstein SR, Rubino F. Metabolic surgery versus conventional medical therapy in patients with type 2 diabetes: 10-year follow-up of an open-label, single-centre, randomised controlled trial. Lancet. 2021 Jan 23;397(10271):293-304. doi: 10.1016/S0140-6736(20)32649-0. PMID: 33485454
32. Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, Kiyosue A, Zhang S, Liu B, Bunck MC, Stefanski A; SURMOUNT-1 Investigators. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 2022 Jul 21;387(3):205-216. doi: 10.1056/NEJMoa2206038. Epub 2022 Jun 4. PMID: 35658024
33. American Diabetes Association Professional Practice, C., et al., 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes-2022. Diabetes Care, 2022. 45(Suppl 1): p. S125-S143
34. Dormandy JA, Charbonnel B, Eckland DJ, Erdmann E, Massi-Benedetti M, Moules IK, Skene AM, Tan MH, Lefèbvre PJ, Murray GD, Standl E, Wilcox RG, Wilhelmsen L, Betteridge J, Birkeland K, Golay A, Heine RJ, Korányi L, Laakso M, Mokán M, Norkus A, Pirags V, Podar T, Scheen A, Scherbaum W, Schernthaner G, Schmitz O, Skrha J, Smith U, Taton J; PROactive Investigators. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet. 2005 Oct 8;366(9493):1279-89. doi: 10.1016/S0140-6736(05)67528-9. PMID: 16214598
35. Feig DS, Donovan LE, Zinman B, Sanchez JJ, Asztalos E, Ryan EA, Fantus IG, Hutton E, Armson AB, Lipscombe LL, Simmons D, Barrett JFR, Karanicolas PJ, Tobin S, McIntyre HD, Tian SY, Tomlinson G, Murphy KE; MiTy Collaborative Group. Metformin in women with type 2 diabetes in pregnancy (MiTy): a multicentre, international, randomised, placebo-controlled trial. Lancet Diabetes Endocrinol. 2020 Oct;8(10):834-844. doi: 10.1016/S2213-8587(20)30310-7. Erratum in: Lancet Diabetes Endocrinol. 2020 Nov;8(11):e6. PMID: 32946820
36. Ibrahim M, Davies MJ, Ahmad E, et al. Recommendations for management of diabetes during Ramadan: update 2020, applying the principles of the ADA/EASD consensus. BMJ Open Diabetes Res Care. 2020;8(1):e001248. doi:10.1136/bmjdrc-2020-001248
37. Alsalim W. Handläggning och behandling av diabetes under ramadan [Management of diabetes during Ramadan]. Lakartidningen. 2022 Feb 24;119:22008. Swedish. PMID: 35233757
38. Rena G, Hardie DG, Pearson ER. The mechanisms of action of metformin. Diabetologia. 2017;60(9):1577-1585
39. de Jager J, Kooy A, Lehert P, et al. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. BMJ. 2010;340:c2181
40. Eppenga WL, Lalmohamed A, Geerts AF, et al. Risk of lactic acidosis or elevated lactate concentrations in metformin users with renal impairment: a population-based cohort study. Diabetes Care. 2014;37(8):2218-2224
41. Verma S, McMurray JJV. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia. 2018;61(10):2108-2117
42. Peters AL, Buschur EO, Buse JB, Cohan P, Diner JC, Hirsch IB. Euglycemic Diabetic Ketoacidosis: A Potential Complication of Treatment With Sodium-Glucose Cotransporter 2 Inhibition. Diabetes Care. 2015;38(9):1687-1693
43. Campbell JE, Drucker DJ. Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab. 2013;17(6):819-837
44. Zimmerman BR. Sulfonylureas. Endocrinol Metab Clin North Am. 1997;26(3):511-522
45. Rosenstock J, Kahn SE, Johansen OE, et al. Effect of Linagliptin vs Glimepiride on Major Adverse Cardiovascular Outcomes in Patients With Type 2 Diabetes: The CAROLINA Randomized Clinical Trial. JAMA. 2019;322(12):1155-1166
46. Vaccaro O, Masulli M, Nicolucci A, et al. Effects on the incidence of cardiovascular events of the addition of pioglitazone versus sulfonylureas in patients with type 2 diabetes inadequately controlled with metformin (TOSCA.IT): a randomised, multicentre trial. Lancet Diabetes Endocrinol. 2017;5(11):887-897
47. Hauner H. The mode of action of thiazolidinediones. Diabetes Metab Res Rev. 2002;18 Suppl 2:S10-15
48. Zhao Q, Li H, Ni Q, Dai Y, Zheng Q, Wang Y, Ke T, Li L, Zhao D, Dong Q, Ji B, Shi J, Peng Y, Zhang Y, Xu F, Wang W. Follow-up frequency and clinical outcomes in patients with type 2 diabetes: A prospective analysis based on multicenter real-world data. J Diabetes. 2022 May;14(5):306-314. doi: 10.1111/1753-0407.13271. PMID: 35613850