Hitta på sidan
Diabetesretinopati – handläggning av proliferativ diabetesretinopati (PDR)
Nationellt kliniskt kunskapsstöd med regionala tillägg.
Diagnoskoder saknas
Diagnoskoder saknas
För närvarande är diagnoskoderna inte tillgängliga.
Omfattning av kunskapsstödet
Kunskapsstödet behandlar handläggning av allvarlig icke-proliferativ diabetesretinopati samt proliferativ diabetesretinopati (PDR).
Andra relaterade kunskapsstöd
Om hälsotillståndet
Definition
Proliferativ diabetesretinopati (PDR) innebär nybildning av blodkärl i ögats näthinna [1]. Kärlnybildning på papillen benämns NVD (New Vessels on the Disc) och kärlnybildning utanför papillområdet kallas NVE (New Vessels Elsewhere). Kärlnybildning kan även uppstå på iris (irisrubeos) samt i kammarvinkeln.
PDR kan leda till preretinal blödning, glaskroppsblödning, retinal traktionsamotio (näthinneavlossning) och neovaskulärt glaukom.
PDR definieras av en eller båda av följande [2]:
- kärlnybildning (neovaskularisering)
- glaskroppsblödning eller preretinal blödning.
PDR med högriskkaraktäristiska (hög risk för mycket snabb progress) föreligger vid en eller båda av följande [3][4][5]:
- kärlnybildningen finns på eller inom 1 papilldiameter av papillen (NVD > 1/4 papillyta)
- diabetesretinopati och samtidig glaskroppsblödning och/eller preretinal blödning oavsett storlek och lokalisation av kärlnybildningen.
Vid allvarlig icke-proliferativ diabetesretinopati föreligger minst ett av följande (4-2-1-regeln) [2]:
- rikligt (> 20) med intraretinala blödningar i var och en av 4 kvadranter
- tydliga venösa kaliberväxlingar i minst 2 kvadranter
- framträdande IRMA (intraretinala mikrovaskulära abnormiteter) i minst 1 kvadrant
- inga tecken på proliferativ diabetesretinopati.
Förekomst
Risken att utveckla PDR är kopplad till sjukdomsduration. Efter 25 års sjukdomsduration vid typ 1-diabetes har omkring 40 % av patienterna utvecklat PDR [6]. Vid typ 2-diabetes är motsvarande siffror för patienter med insulinbehandling 20 % och för patienter utan insulinbehandling 10 %. Nyare data på mindre material har visat på lägre incidenssiffror, speciellt hos patienter med välreglerat blodsocker [7].
Riskfaktorer
Oberoende riskfaktorer [8][9][10]vid aktuellt observationstillfälle för att utveckla PDR utgör:
- högt HbA1c
- allvarligare grad av retinopati.
Biomarkörer för njursjukdom är associerat med ökad risk att diabetesretinopati progredierar till PDR. Hos personer med typ 1-diabetes är även ålder vid diabetesdiagnos, förhöjda triglyceridnivåer samt dilaterade retinala vener förknippat med denna ökade risk [8][9][10][11].
Risk för progress till PDR föreligger även vid snabb förbättring av metabol kontroll samt vid graviditet, vid samtidig förekomst av minst måttlig DR [12].
Utredning
Symtom
PDR ger i sig inga symtom så länge det inte utvecklats en blödning i ögats glaskropp, traktionsamotio eller neovaskulärt glaukom. En blödning i ögats glaskropp orsakar en plötslig synnedsättning i det drabbade ögat. Traktionsamotio medför en progredierande synnedsättning som kan utvecklas inom dagar till veckor. Neovaskulärt glaukom innebär en ökning av det intraokulära ögontrycket, vilket kan ge värk och synnedsättning.
Anamnes
I anamnesen bör förekomst av riskfaktorer kartläggas.
Status
I ögonstatus för att fastställa PDR ingår:
- undersökning med biomikroskopi eller jämförbar bilddiagnostisk undersökning
- övervägande av odilaterad undersökning av iris samt gonioskopi.
Handläggning vid utredning
Dokumentera ögonstatus med tillgänglig bilddiagnostik (imaging) som bedöms vara lämplig för att kunna följa progress och regress [13]utifrån patientens status som till exempel:
- ögonbottenfoto inkluderande perifera och centrala näthinnan, rödfritt och/eller färg
- OCT vid misstanke om förekomst av makulaödem alternativt traktion
- WF OCTA (Wide Field Optical Coherence Tomography Angiography), som kan möjliggöra kartläggning av ischemi och kärlnybildning centralt och perifert
- FA (fluoresceinangiografi), som kan övervägas i enstaka fall vid osäker diagnos
- FAF (fundus autofluorescens), som påvisar lasereffekter i näthinnan
- Ultraljud B-scan, som används vid oklara medier för att bedöma:
- glaskroppsblödning
- traktionsamotio
- subhyaloidal blödning.
Differentialdiagnoser
Differentialdiagnoser till PDR är:
- retinal venocklusion (RVO)
- okulärt ischemiskt syndrom
- uveit.
Behandling
Handläggning vid behandling
Handläggning vid olika typer av PDR
Handläggning vid olika typer av PDR sker enligt följande:
- Vid PDR med högriskkaraktäristika, behandla skyndsamt.
- PDR utan högriskkaraktäristiska bör behandlas i de flesta fall. I enstaka fall kan små icke-progredierande proliferationer i bakre segmentet åtminstone initialt observeras.
- Vid allvarlig icke PDR (4-2-1-regel) kan behandling övervägas vid till exempel bristfällig compliance, graviditet eller planer på graviditet. Beakta riskfaktorer och gör en individuell bedömning.
Panretinal fotokoagulation – laserbehandling
Panretinal fotokoagulation (PRP), så kallad scatterbehandling, innebär att näthinnan perifert om kärlbågarna täcks med jämnt utspridda lasereffekter. Behandlingens gränser mot bakre polen är de superiora och inferiora kärlbågarna, samt temporalt 2 papilldiametrar (ppd) distalt om fovea och nasalt 0,5–1 ppd från papillen. Effekterna ska vara tydliga och gråaktiga men inte vita. Det är viktigt att täcka hela näthinnan långt ut i periferin och även temporalt om makula.
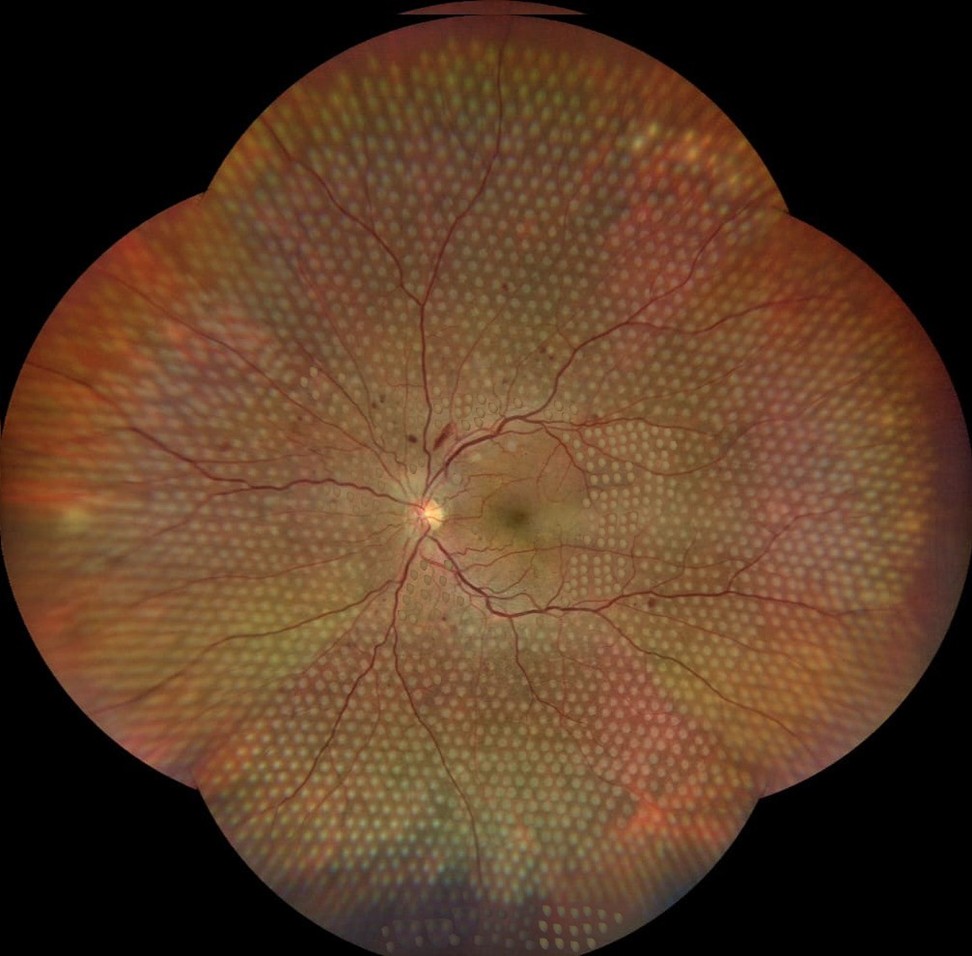
Lasertyper
Det finns olika typer av laser tillgängliga. Typ av apparatur, storlek på lasereffekten, avstånd mellan effekterna, energi och pulsduration har betydelse för hur många lasereffekter som krävs för full PRP [14].
Laser med lång effektduration
Vid användning av konventionell laser (532 nm) bör inställningarna vara pulsduration minst 100 ms, spotstorlek 200–500 µm på näthinnan, 0,5–1 spotdiameter mellan effekterna PRP, vilket innebär minst 1200–1600 effekter för heltäckande PRP. Behandlingen kompletteras utifrån kliniskt svar [2][15]. Liknande inställningar kan användas för laser med våglängd 532–577 nm.
Laser med kort effektduration
Vid användning av laser med kort effektdurationvåglängd 532–577 nm [16] bör inställningarna vara pulsduration 10–30 ms och spotstorlek 200–500 µm på näthinnan. Kortare avstånd mellan effekterna (information finns i leverantörsinstruktioner) används jämfört med laser med lång effektduration och fler effekter får plats. Ofta krävs 3000 eller fler effekter (upp till 7000) för heltäckande PRP [17]. Kort effektduration möjliggör multispotbehandling.
Multispotbehandling med kort effektduration har i uppföljning upp till 18 månader visats lika effektivt vad gäller regress av proliferationer som konventionell laserbehandling med lång effektduration [18][19]. Längre uppföljningar finns för närvarande inte publicerade. Laser med kort effektduration upplevs ofta som mindre smärtsamt jämfört med laserbehandling med lång effektduration [20][21].
Smärtlindring vid laserbehandling
Laserbehandling görs vanligen efter droppbedövning med lokalanestetika. Ytterligare smärtlindring i form av subtenonal eller retrobulbär injektion av lokalanestetika och/eller peroralt analgetika kan övervägas. Laserbehandling kan upplevas som starkt bländande.
Anti-VEGF-behandling
Behandling med anti-VEGF-injektioner i ögats glaskropp är effektivt för att få proliferationer att gå tillbaka [22][23][24]. Månatliga glaskroppsinjektioner under upp till 2 års tid har getts [22][23][24]. Effekten är inte bestående utan proliferationerna återkommer då effekten av anti-VEGF läkemedlet har upphört.
Injektionsbehandling med anti-VEGF-läkemedel rekommenderas inte som monoterapi för behandling av PDR, då behandlingseffekten inte är bestående och kräver strikt compliance och monitorering [25]. Fler långtidsstudier behövs.
Handläggning i särskilda kliniska situationer
PDR med samtidigt centralt synnedsättande diabetesmakulaödem
Vid PDR med samtidigt central synnedsättande diabetesmakulaödem rekommenderas kombinationsbehandling med PRP och anti-VEGF-injektioner (PRP + anti-VEGF) [26]. Mer information finns i det kliniska kunskapsstödet Riktlinje för injektionsbehandling av synnedsättande centralt diabetesmakulaödem (CIDME).
Högrisk-PDR där fullständig fotokoagulation inte är möjlig
Vid högrisk-PDR där fullständig fotokoagulation inte är möjlig, överväg perifer retinal kryopexi, perifer retinal diodlaser eller vitrektomi med möjlighet till endolaser [26].
Mycket snabbt progredierande proliferativ diabetesretinopati
Vid mycket snabbt progredierande proliferativ diabetesretinopati kan prompt injektionsbehandling med anti-VEGF starkt rekommenderas parallellt till skyndsam PRP för att vinna tid och minska risken för skymmande blödningar under tiden som PRP utförs och tills denna har full effekt.
Glaskroppsblödning vid PDR
Om det inte finns någon annan förklaring som till exempel retinal ruptur förutsätts glaskroppsblödningen bero på PDR, som skyndsamt ska behandlas.
Om insynen är kraftigt påverkad utförs ultraljud för att utesluta amotio. Patienter utan tidigare genomförd PRP kontrolleras med individualiserade intervall (3–7 dagar) för att utesluta amotio tills dess att näthinnan kan visualiseras.
PRP av synliga delar av näthinnan ska påbörjas så fort som möjligt. Anti-VEGF-injektion kan övervägas i syfte att minska risken för ny glaskroppsblödning under förutsättning att risk för fibrovaskulär traktion kan bedömas [27][28]. Överväg remiss för tidig vitrektomi om näthinnan inte kan visualiseras inom 1–2 veckor.
Hos patient med tidigare genomförd PRP finns flera handläggningsalternativ. Man kan överväga att avvakta 1 månad. Man kan överväga injektion av anti-VEGF i syfte att minska risken för ny glaskroppsblödning. Tidigare PRP ska kompletteras när så är möjligt. Det är viktigt att patienten har en så heltäckande PRP som möjligt. Överväg remiss för vitrektomi efter 1–3 månader (beroende på insyn) utan uppklarning [29].
Irisrubeos och/eller kärlnybildning i kammarvinkeln
Handläggningen vid kärlnybildning på regnbågshinnan och eller i kammarvinkeln påverkas av om det föreligger tryckstegring eller inte, samt om kammarvinkeln är öppen eller stängd.
Handläggning vid avsaknad av tryckstegring:
- Överväg anti-VEGF-behandling.
- Prompt PRP, som bör vara avslutad inom 1 månad.
Handläggning vid tryckstegring och öppen kammarvinkel:
- Sänk ögontrycket och ge antiinflammatorisk behandling med steroider.
- Överväg starkt anti-VEGF-behandling.
- Prompt PRP inom 1 månad.
- Överväg perifer retinal diodlaserbehandling.
- Vid behandlingssvikt, överväg annan operativ åtgärd avseende tryckstegring såsom cyklodiodlaser eller ventiloperation.
Handläggning vid tryckstegring och stängd kammarvinkel:
- Kirurgisk åtgärd ska övervägas tidigt. Anti-VEGF och PRP har ingen kliniskt relevant effekt på intraokulärt tryck vid irisrubeos med sluten kammarvinkel.
Vid mycket låg synfunktion ska behandlingsmålet vara smärtfrihet.
Vitrektomi
Indikationer för vitrektomi är:
- ej uppklarnande glaskropps-, subhyaloidal- eller pre-makulablödning
- tätt recidiverande glaskroppsblödningar trots PRP
- vitreoretinal traktion med risk för synpåverkan.
Samråd med vitreoretinalkirurg rekommenderas gällande indikation för vitrektomi och preoperativ anti-VEGF-behandling [29][30].
Rehabilitering
Om patienten uppfyller kriterier för remiss till syncentral och så önskar, skicka remiss till syncentral för synrehabiliterande insatser och utprovning av hjälpmedel. En person med synnedsättning kan behöva stöd i form av strategier och hjälpmedel eller psykosocialt stöd för att klara det dagliga livet.
Uppföljning
Uppföljning efter PRP bör ske senast efter 3–4 månader genom klinisk undersökning och/eller ögonbottenfoto och kan innefatta OCT. Kontrollintervallen kan successivt förlängas upp till kontroll varje eller vartannat år vid stabilt ögonstatus.
Komplikationer
Komplikationer av behandling
Laserbehandling
Ärren efter laserbehandling kan växa med tiden, så kallad creeping, med risk för uppkomst av konfluerande atrofier av pigmentepitelet. Om dessa är mycket uttalade kan de påverka synfältet och mörkerseendet. Mot bakgrund av detta begär Transportstyrelsen synfältsundersökning för bedömning av körkortsbehörighet hos personer som har behandlats med PRP. Studier saknas gällande långtidsuppföljning efter laser med kort effektduration.
Injektionsbehandling med anti-VEGF-läkemedel
Komplikationer till anti-VEGF-behandling är huvudsakligen injektionsrelaterade så som irritation, rodnad, ytligt sår på hornhinnan, blödning i bindehinnan, intraokulär blödning, intraokulär inflammation, förhöjt intraokulär tryck, näthinneruptur, näthinneavlossning, iatrogen traumatisk katarakt samt intraokulär infektion (endoftalmit). Endoftalmit är den allvarligaste komplikationen. Incidensen av endoftalmit är 1:2000–3000 glaskroppsinjektioner [31]. För individen innebär varje injektion kumulativt ökad risk för endoftalmit.
Det finns rapporter om ökande fibrovaskulär traktion, så kallad crunching, vid anti-VEGF-behandling för PDR [32]men även rapporter med motsatt resultat [33]. Noggrann uppföljning och samråd med vitreoretinalkirurg rekommenderas.
Kvalitetsuppföljning
Indikatorer för uppföljning
Data från Svenska Makularegistret (SMR) kan endast i begränsad utsträckning användas för kvalitetsuppföljning av behandling för PDR.
Patientansvarig diabetesläkare kan rapportera till Nationella Diabetesregistret (NDR) att patienten fått behandling för synhotande diabetesretinopati senaste året samt om patientens synskärpa är ≤ 0,3 på grund av diabetesretinopati.
Kvalitetsregister
Injektionsbehandling med anti-VEGF-läkemedel för PDR bör registreras i SMR.
Relaterad information
Kompletterande underlag
1. Crabtree GS and Chang JS. Management of complications and vision loss from proliferative diabetic retinopathy. Curr Diab Rep 2021;21:33. doi: 10.1007/s11892-021-01396-2
2. Wilkinson CP, Ferris FL, Klein RE; Lee PP, Agard CD, Davis M, Dills D, Kampik A, Pararajasegaram R, Verdaguer JT. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales. Ophthalmology 2003; 110:1677-1682.
3. The Diabetic Retinopathy Study Research Group. Photocoagulation treatment of proliferative diabetic retinopathy. Clinical application of Diabetic Retinopathy Study (DRS) findings, DRS Report no 8. Ophthalmology 1981;88:P583-600. doi:10.1016/S0161-6420(81)34978-1.
4. The ETDRS study research group. Grading diabetic retinopathy from stereoscopic color fundus photographs – An extension of the modified Airlie house classification. ETDRS report number 10. Ophthalmogy 1998;786-806.
5. The ETDRS study research group. Fundus photographic risk factors for progression of diabetic retinopathy. ETDRS report number 12. Ophthalmology 1991;98:823-833.
6. Klein R, Knudtson M, Lee KE, Gangnon R, Klein BEK. The Wisconsin epidemiologic study of diabetic retinopathy XXII. The twenty-five-year progression of retinopathy in persons with type 1 diabetes mellitus. Ophthalmology 2008;115:1859-1868.
7. Cheung N, Mitchell P and Wong, TY. Diabetic retinopathy. Lancet 2010;376;124-136. doi: 10.1016/S0140-6736(09)62124-3.
8. Tarasewicz D, Conell C, Gilliam LK and Melles RB. Quantification of risk factors for diabetic retinopathy progression. Acta Diabetol 2023;60: 363-369. doi: 10.1007/s00592-022-02007-6
9. Perais J, Agarwal R, Evans JR, Loveman E, Colquitt JL, Owens D, Hogg RE, Lawrenson JG, Takwoingi Y, Lois N. Prognostic factors for the development and progression of proliferative diabetic retinopathy in people with diabetic retinopathy. Cochrane Database Syst Rev 2023;2:CD013775. doi: 10.1002/14651858.CD013775.pub2.
10. Dinesen S, Stokholm L, Subhi Y, Peto T, Savarimuthu TR, Andersen N, Andresen J, Bek T, Hajari J, Heegaard S, Hojlund K, Laugesen Cs, Kawasaki R, Möller S, Schielke K, Thykjaer AS, Pederesn F, Grauslund J. Five-year incidence of proliferative diabetic retinopathy and associated risk factors in a nationwide cohort of 201 945 Danish patients with diabetes. Ophthalmol Sci 2023;3:100291. doi: 10.1016/jxops.2023.100291.
11. Rathsman B, Haas J, Persson M, Ludvigsson J, Svensson AM, Lind M, Andersson Franko M, Nyström T. LDL cholesterol level as a risk factor for retinopathy and nephropathy in children and adults with type 1 diabetes mellitus: A nationwide cohort study. J Intern Med 2021;289:873-886. doi: 10.1111/joim.13212.
12. Feldman-Billard S, Larger , Massin P. Early worsening of diabetic retinopathy after rapid improvement of blood glucose control in patients with diabetes. Diabetes Metab 2018;44:4-14. doi: 10.1016/j.diabet.2017.10.014.
13. Nanegrungsunk O, Patikulsila D, Sadda SR. Ophthalmic imaging in diabetic retinopathy: A review. Clin Exp Ophthalmol 2022;50:1082-1096. doi: 10.1111/ceo.14170.
14. Nishida K, Miura K, Sakaguchi H, Kamei M, Wakabayashi T, Hara C, Sateimuto S, Fukushima Y, Sayanagi K, Sato S, Fukuda M, Nishida K. The impact of spot size, spacing, pattern, duration and intensity of burns on the photocoagulation index in a geometric simulation of pantretinal laser photocoagulation. Acta Ophthalmol 2019:97:e551-e558. doi:10.1111/aos13939
15. ETDRS study research group. Techniques for scatter and local photocoagulation treatment of diabetic retinopathy. ETDRS report 3. Int Ophthalmol Clin 1987;27:254-264.
16. Nagpal M, Marlecha S, Nagpal K. Comparison of laser photocoagulation for diabetic retinopathy using 532-nm standard laser versus multispot pattern scan laser. Retina 2010;30:452-458. doi: 10.1097/IAE.0b013d318c70127.
17. Muqit MMK, Marcellino GR, Henson DB, Young LB, Patton N, Charles SJ, Turner GS, Stanga PE. Single-session vs multiple-session pattern scanning laser panretinal photocoagulation in proliferative diabetic retinopathy. The Manchester Pascal study. Arch Ophthalmol 2010;128:525-533. doi: 10.1001/archophthalmol.2010.60
18. Muqit MMK, Marcellino GR, Henson DB, Young LB, Turner GS, Stanga PE. Pascal panretinal laser ablation and regression analysis in proliferative diabetic retinopathy: Manchester Pascal Study Report 4. Eye 2011;25:1447-1456. doi: 10.1038/eye.2011.188.
19. Passos RM, Belucio-Neto J, Xavier CO, Novais EA, Maia M, Farah ME. Comparison of 577-nm multispot and standard single-spot photocoagulation for diabetic retinopathy. Ophthalmologica 2019;241:202-210. doi: 10.1159/000493280.
20. Amoroso F, Pedinielli A, Astroz P, Semoun O, Capuano V, Miere A, Souied EH. Comparison of pain experience and time required for pre-planned navigated peripheral laser versus conventional multispot laser in the treatment of diabetic retinopathy. Acta Diabetol 2020;57:535-541. doi:10.1007/s00592-019-01455-x.
21. Barbosa GC, Silva AG, Susanna BN, Masseo TM, Bermudes FH, Machado CG, Gomes AV. Pain Perception of patients undergoing laser panretinal photocoagulation: comparison of single-psot versus multispot techniques. Ophthalmic Surg Lasers Imaging Retina 2022;53:40-45. doi: 10.3928/23258160-20211223-01.
22. Sivaprasad S, Prevost AT, Vasconcelos JC, Riddell A, Murphy C, Kelly J,Bainbridge J, Tudor-Edwards R, Hopkins D, Hykin P . Clinical efficacy of intravitreal aflibercept versus panretinal photocoagulation for best corrected visual acuity in patientswith proliferative diabetic retinopathy at 52 weeks (CLARITY): a multicentre, single-blinded, randomised, controlled, phase 2b, non-inferiority trial. Lancet 2017;389:2193–2203. doi: 10.1016/S0140-6736(17)31193-5.
23. Figueira J, Fletcher E, Massin P, Silva R, Bandello F, Midena E, Varano M, Sivaprasad S, Eleftheriadis H, Menon G, Amaro M, Scheer SA, Creuzot-Garcher C, Nascimento J, Alves D, Nunes S, Lobo C, Cunha-Vaz J, EVICR.net Study Group. Ranibizumab plus panretinal photocoagulation versus panretinal photocoagulation alone for high-risk proliferative diabetic retinopathy (PROTEUS study). Ophthalmology 2018;125:691-700. doi: 10.1016/j.ophtha.2017.12.008.
24. Sun JK; Glassman AR; Beaulieu WT, Stockdale CR; Bressler NM, Flaxel C, Gross JG, Shami, Jampol LM, Diabetic Retinopathy Clinical Research Network. Rationale and Application of the Protocol S Anti-Vascular Endothelial Growth Factor Algorithm for Proliferative Diabetic Retinopathy. Ophthalmology 2019;126:87-95. doi: 10.1016/j.ophtha.2018.08.001.
25. Obeid A, Su D, Patel SN, Uhr JH, Borkar D, Gao Z, Fineman MS, Regillo CD, Maguire JI, Garg SJ, Hsu J. Outcomes of eyes lost to follow-up with proliferative diabetic retinopathy that received panretinal photocoagulation versus intravitreal anti-vascular endothelial growth factor. Ophthalmology 2019;126:407-413. doi:10.1016/j.ophtha2018.07.027
26. Fu P, Huang Y, Wan X, Zuo H, Yang Y, Shi R, Huang M. Efficacy and safety of pan retinal photocoagulation combined with intravitreal anti-VEGF agents for high-risk proliferative diabetic retinopathy: a systematic review and meta-analysis. Medicine 2023;102:e39. doi: 10.1097/MD0000000000034856.
27. Antoszyk AN, Glassman AR, Beaulieu WT, Jampol LM, Jhaveri CD, Punjabi OS, Salehi-Had H, Wells JA; Maguire MG, Stockdale CR, Martin DF, Sun JK, DRCRnet Retina Network. Effect of intravitreous aflibercept vs vitrectomy with panretinal photocoagulation on visual acuity in patients with vitreous hemorrhage from proliferative diabetic retinopathy. A randomized clinical trial. JAMA 2020;324:2383-2395. doi: 10.1001/jama.2020.2302
28. Wirkkala J, Bloigu R, Hantala NM. Intravitreal bevacizumab improves the clearance of vitreous haemorrhage and visual outcomes in patients with proliferative diabetic retinopaty. BMJ Open Ophthalmol 2019;4:e000390. doi: 10.1136/bmjophth-2019-000390.
29. Anguita R, Desideri LF; Schwember P, Shah N, Ahmed S, Raharja A, Roth J, Sivaprasad S, Wickham L, Early versus delayed vitrectomy for vitreous haemorrhage secondary to proliferative diabetic retinopathy. Am J Ophthalmol 2025;270:237-244. E-pub. Doi 10.1016/j.ajo.2024.10.01
30. Pei M, Zhao X, Wan G. A Systematic Review and Meta-Analysis of Clinical Outcomes of Small Gauge Vitrectomy with or without Intravitreal Anti-Vascular Endothelial Growth Factor Agents Pretreatment for Proliferative Diabetic Retinopathy. Ophthalmic Res 2023;66:777-790. doi: 10.1159/000530231
31. SMR Årsrapport 2022. https://rcsyd.se/makulareg/wp-content/uploads/sites/2/2023/10/Arsrapport-2022.pdf
32. Tan Y, Fukutomi A, Sun MT; Durkin S, Gilhotra J, Chan WO. Anti-VEGF crunch syndrome in proliferative diabetic retinopathy: a review. Surv Ophthalmol 2021;66:926-932. doi: 10.1016/j.survophthal.2021.03.001.
33. Bressler NM, Beaulieu WT, Bressler SB, Glassman AR, Melia BM, Jampol LM, Jhaveri CD, Salehi-Had H, Velez G, Sun JK, DRCR Retina Network. Anti-vascular endothelial growth factor therapy and risk of traction retinal detachment in eyes with proliferative diabetic retinopathy: pooled analysis of five DRCR Retina network randomized clinical trials. Retina 2020;40:1021-1028. doi: 10.1097/IAE.0000000000002633.