Hitta på sidan
Lungfibros - vuxna
Nationellt vårdförlopp med regionala tillägg.
Omfattning av kunskapsstödet
Vårdförloppet inleds vid symtom eller undersökningsfynd som kan vara förenliga med lungfibros hos en patient och pågår vanligen livet ut. En fullständig beskrivning av kriterier för omfattningen finns under rubriken Ingång och utgång.
Relaterade kunskapsstöd
Se Nationellt kliniskt kunskapsstöd (nationelltklinisktkunskapsstod.se) för följande relaterade kunskapsstöd:
- Personcentrerade och sammanhållna vårdförlopp för:
- kroniskt obstruktiv lungsjukdom
- obstruktiv sömnapné
- palliativ vård
- rehabilitering och försäkringsmedicinskt arbete
- reumatoid artrit
- hjärtsvikt.
- Kliniska kunskapsstöd för:
- sarkoidos
- andningsbesvär palliativ vård.
- Vårdriktlinje för:
-
- systemisk skleros.
Om hälsotillståndet
Definition
Lungfibros är ett samlingsbegrepp för tillstånd med ärromvandling av lungvävnad och ingår i gruppen interstitiell lungsjukdom (ILD) [1]. Vårdförlopp lungfibros inkluderar en heterogen grupp inom de interstitiella lungsjukdomarna, där det gemensamma är progredierande eller risk för progredierande fibrotisering av lungvävnad. Lungfibros är ett vardagligt och ospecifikt begrepp som används i kommunikation med allmänheten för att generellt beskriva fibrotiserande ILD.
Se bilaga kompletterande bakgrund om interstitiell lungsjukdom (ILD).
|
Förkortning/begrepp |
Beskrivning |
|
ILD |
Interstitiell lungsjukdom |
|
Lungfibros |
Beskriver ILD där delar av lungvävnaden omvandlats till ärrvävnad |
|
Fibros |
Onormal bindvävsbildning/ärrbildning, jämför lungfibros |
|
Reaktiv fibros |
Fibros av begränsad omfattning och resultat av känd extern påverkan |
|
Fibrotiserande lungsjukdom |
Fibros i lungvävnaden som riskerar att öka i omfattning |
|
IPF |
Idiopatisk lungfibros. Tillhör de fibrotiserande lungsjukdomarna |
|
UIP |
Radiologiskt mönster som ses vid IPF, och ibland vid annan fibrotiserande lungsjukdom |
|
PPF |
Progressiv lungfibros som uppfyller kriterier för försämringen. Tillhör de fibrotiserande lungsjukdomarna |
|
SSc |
Systemisk skleros |
|
RA |
Reumatoid artrit |
|
SLE |
Systemisk lupus erythematosus |
Interstitiell lungsjukdom (ILD)
Interstitiell lungsjukdom (interstitial lung disease, ILD) är ett begrepp som beskriver en heterogen grupp av lungsjukdomar [1]. ILD drabbar båda lungorna i varierande grad och omfattar ett stort antal tillstånd med ett brett spektrum av orsaker [2]. Vidare finns varierande kliniska och radiologiska manifestationer samt patologiska karakteristika, och därmed också varierande utfall [1, 3-6]. Eftersom de patologiska förändringar som drabbar patienten huvudsakligen förekommer i lungans bindväv (området mellan lungcellerna, även kallat interstitium), kallas denna grupp av sjukdomar för interstitiella lungsjukdomar (ILD) [1].
ILD där det förekommer ärromvandling av lungparenkymet är fibrotisk och benämns i allmänhet ofta ”lungfibros” [2]. ILD som är icke-fibrotisk [7] kan läka ut, ibland av sig självt men ibland med hjälp av (immunmodulerande) läkemedelsbehandling, men kan även i vissa fall övergå i fibrotiserande lungsjukdom. Lungfibros utvecklas inte hos alla patienter med ILD. Det finns i dag inte några metoder för att avgöra om en patient kommer att utveckla lungfibros, men vissa tillstånd innebär större risk (se riskfaktorer) [1, 3-6].
Se bilaga kompletterande bakgrund om interstitiell lungsjukdom (ILD).
Lungfibros
Begreppet lungfibros beskriver tillståndet där delar av lungvävnaden omvandlats till ärrvävnad [1, 2, 7]. Det kan ske vid flera sjukdomar och tillstånd som ryms under det övergripande begreppet interstitiell lungsjukdom (ILD) [1]. Fibrotisering är en skada som inte är reversibel. Vid lungfibros som orsakats av specifik exponering, exempelvis asbestos, kan den avstanna efter att orsaken avlägsnats. Fibrotisering som inte avstannar benämns progressiv och innebär att en allt större del av patientens lungvävnad successivt fibrotiseras [1, 2, 7].
Termen "fibros" betyder onormal bindvävsbildning/ärrbildning. Det är en strikt beskrivande term som inte innehåller uppgifter om bakomliggande orsak. När den onormala bindvävsbildningen/ärrbildningen sker i lungvävnaden används ofta termen ”lungfibros”. På samma sätt som termen "fibros" är den enbart beskrivande och innehåller inga uppgifter om sin bakomliggande orsak [1].
Lungfibros kan ha många orsaker och kan delas in i två huvudkategorier [1-3, 7]:
- Reaktiv fibros: Fibros som är av begränsad omfattning och resultat av känd extern påverkan. Ett exempel på detta är fibros som kan komma efter strålbehandling eller efter svåra lung- och lungsäcksinfektioner.
- Fibrotiserande lungsjukdom:Fibros i lungvävnaden som riskerar att progrediera (öka i omfattning). Det finns ett antal olika former med varierande prognos och förlopp, den mest välkända är idiopatisk lungfibros (idiopathic pulmonary fibrosis, IPF).
Termen "lungfibros" har sedan flera år använts som ett övergripande begrepp för såväl reaktiva förändringar som för fibrotiserande lungsjukdomar. De senaste decennierna har de fibrotiserande lungsjukdomarna kommit i fokus med ökad kunskap om behandling och prognos. Det har uppstått ett behov att differentiera mellan dessa två kategorier av fibros, dels för att bespara patienterna onödig oro, dels för att kunna fokusera på den kategori patienter som har större behov av omhändertagande och behandling [2, 7].
Idiopatisk lungfibros (IPF)
De fibrotiserande lungsjukdomarna kan delas in i specifika medicinska diagnoser. IPF är den fibrotiserande lungsjukdom som är mest beskriven och karakteriserad [3, 8-10]. Utmärkande för IPF är att diagnosen ställs genom usual interstitial pneumonia (UIP)-mönster tillsammans med klinisk bild. UIP-mönster kan förekomma på [8]:
- högupplöst datortomografi (high resolution computed tomography, HRCT) (se diagnoskriterier)
- datortomografi (DT) vid utbredd fibrotisering
- vävnadsprov (biopsi) från lungan.
IPF är bland de ILD-sjukdomar med sämst prognos. Utan sjukdomsspecifika läkemedel beräknas, i olika studier, överlevnaden till mellan tre och fem år från diagnos, variation förekommer [3, 4, 8, 11]. Detta vårdförlopp refererar därför ibland till erfarenheter från specifikt IPF men konsensus är att det är applicerbart även på övrig progressiv fibrotiserande lungsjukdom [1].
Progressiv lungfibros (PPF)
Progressiv lungfibros (progressive pulmonary fibrosis, PPF) är en allmän definition för patienter med progressiv fibrotiserande lungsjukdom, annan än IPF, av känd eller okänd bakomliggande orsak [3].
ILD vid autoimmun sjukdom
ILD med risk för, eller utvecklad, fibrotiserande lungsjukdom förekommer i hög men varierande frekvens vid flera autoimmuna sjukdomar [2, 5, 12], framför allt hos patienter med:
- systemisk skleros (SSc)
- inflammatorisk idiopatisk myopati (myosit)
- reumatoid artrit (RA).
Det förekommer även vid följande tillstånd:
- Sjögrens syndrom
- systemisk lupus erythematosus (SLE)
- andra inflammatoriska systemsjukdomar.
Förekomst
Interstitiell lungsjukdom (ILD) - Prevalensen för ILD är 6—76/100 000 [1, 2, 8, 11, 13, 14].
Idiopatisk lungfibros (IPF) - IPF är den variant av fibrotiserande lungsjukdom som är bäst beskriven vad gäller prevalens [8, 15]. I Finland beräknades den till 1–28/100 000 med en incidens på 1–9/100 000 per år [8]. En översikt från Tyskland visar en punktprevalens på strax ovan 20/100 000 och en incidens på strax ovan 10/100 000, per år [9]. Svenska siffror är osäkra men tyder på liknande resultat. IPF är associerat till manligt kön och rökning [8, 11, 15].
ILD vid autoimmun sjukdom - ILD kan detekteras hos 30-70 % av patienter med systemisk skleros, 30—60 % av patienter med RA och upp till 80 % av dem med myosit [12-14, 16].
Orsaker
Lungfibros uppstår efter mikroskopisk skada i alveolärepitelet som inte läkt korrekt utan orsakat ärrbildning och därigenom sämre förmåga för syrgasutbyte [1]. Kända orsaker kan vara [1, 6, 17]:
- exponering för till exempel stendamm, asbest, strålbehandling
- autoimmun sjukdom
- läkemedel.
Lungfibros av okänd orsak benämns idiopatisk, exempelvis IPF (idiopatisk lungfibros).
Riskfaktorer
Ökad risk för lungfibros finns hos personer med [7, 10, 18]:
- pågående eller tidigare rökning
- exponering för partiklar
- interstitiella lungabnormaliteter (ILA).
Diagnoskriterier
Diagnosticering av lungfibros baseras i första hand på radiologiskt mönster från HRCT tillsammans med den kliniska bilden (anamnes, status samt förlopp) [2-4, 7, 8, 10, 19 ].
- Se åtgärd (A) samlad bedömning av anamnes, status och utredningsfynd.
- Se bilagor anamnes samt klinisk undersökning och utredning.
Bronkoskopi med bronkoalveolärt lavage (BAL) och/eller lungbiopsi kan bli aktuell om diagnos inte kan ställas med ovanstående underlag [3, 7, 8, 10].
Radiologi
Den radiologiska bilden i form av HRCT är en hörnsten i diagnosticering av ILD och särskilt fibrotiserande lungsjukdom [2-4, 7, 8, 10, 19]. Se även åtgärd (C).
Vid IPF kallas det radiologiska mönstret usual interstitial pneumonia (UIP) [7, 8, 19]. Mönstret kan även förekomma vid andra fibrotiserande lungsjukdomar, exempelvis vid fibrotiserande lungsjukdom associerad till RA [2].
Non-specific interstitial pneumonia (NSIP) är det mönster som ses vid sjukdomen idiopatisk NSIP (iNSIP) men även vid lungfibros associerad till autoimmun sjukdom. Organiserande pneumoni (OP) kan vara idiopatisk eller associerad till bland annat autoimmuna sjukdomar, infektioner och läkemedel [2, 4-6, 16].
Lungfunktionsmätning
Dynamisk spirometri kan väcka misstanke om restriktivitet men det är med statisk spirometri som sänkta lungvolymer säkerställs. Vid lungfibros finns ofta en restriktiv bild mätt med dynamisk och statisk spirometri samt nedsatt diffusionskapacitet för kolmonoxid (DLCO). Vid en blandbild av emfysem och fibros kan den dynamiska och statiska spirometrin vara helt normal men då är diffusionskapaciteten påverkad. [1-3, 7, 8, 10]
Se även artikel i European respiratory journal från 2022, ERS/ATS technical standard on interpretive strategies for routine lung function tests.
Multidisciplinär konferens (MDK)
Multidisciplinär konferens (MDK) bör skiljas från en vanlig röntgenrond. I MDK deltar [2-4, 8]:
- lungspecialister
- thoraxradiolog alternativt ILD-erfaren radiolog.
Samt utifrån behov:
- reumatolog
- klinisk fysiolog
- patolog
- thoraxkirurg
- kardiolog.
Dessa analyserar i samverkan olika aspekter av patientens besvär och undersökningsresultat, och kan därigenom diagnosticera ILD-sjukdomen samt ge förslag på fortsatt omhändertagande och behandling [2-4, 8].
Diagnostisering av progressiv lungfibros (PPF)
Radiologisk bild av fibrotiserande lungsjukdom och minst två av följande tre kriterier som inträffat under det senaste året utan annan alternativ förklaring till försämring [3]:
- förvärrade lungsymtom (hosta, andfåddhet)
- försämring av lungfunktion (mätt med FVC och DLCOc)
- progress av radiologiska förändringar.
Se åtgärd (K).
Fibrotiserande lungsjukdom vid autoimmun sjukdom
Vid progressiv fibrotiserande lungsjukdom associerad till autoimmun sjukdom, trots antireumatisk behandling, föreslås MDK där reumatolog, lungmedicinspecialist, thorax- /ILD-erfaren radiolog och vid behov klinisk fysiolog deltar [2-7, 16].
Vid både systemisk skleros och myosit ingår radiologisk utredning med HRCT och lungfunktionsundersökning inklusive mätning av DLCOc i den basala utredningen. Lungröntgen ingår i den initiala handläggningen vid RA, med kompletterande HRCT vid avvikande fynd.
Samsjuklighet
Tillstånd som kan förekomma samtidigt som ILD med eller utan lungfibros är reflux, astma, kroniskt obstruktiv lungsjukdom (KOL), hjärtsvikt, ångest samt post-infektiöst tillstånd [8, 17].
Tillstånd med ökad förekomst hos patienter med IPF jämfört med övrig population [8]:
- gastroesofageal reflux (GERD)
- obstruktiv sömnapné
- pulmonell hypertension
- kranskärlssjukdom
- kroniskt obstruktiv lungsjukdom (KOL)
- ångest/depression
- diabetes
- hjärtsvikt
- lungcancer
- lungemboli.
Sjukdomsförlopp
Dyspné, torrhosta och fatigue (trötthet) är initiala symtom, men är ospecifika för ILD inklusive lungfibros. Det är därför viktigt att utredning av sådana symtom inte avstannar utan att orsak identifieras och eventuella differentialdiagnoser utesluts [2-4, 8, 10, 18].
Från de första symtomen på ILD kan sjukdomen utvecklas på olika sätt beroende på om fibrotisering av lungvävnaden uppstår eller ej. Eftersom fibrotiserande lungsjukdom orsakar permanent lungfunktionsnedsättning innebär det därför generellt fler och mer uttalade svårigheter för patienten [1-5, 7, 8, 10, 12, 13, 17, 18]. Nedsatt ork och ökad dyspné begränsar aktiviteter i dagliga livet, därför är det av stor vikt att patienten får kunskap om och förstår hur hen kan hantera sjukdomens symptom i vardagen och på så vis möjliggöra att fortsätta utföra de aktiviteter som upplevs som meningsfulla [20, 21].
Progressiv fibrotiserande lungsjukdom och IPF orsakar en kontinuerlig förlust av lungfunktion med påföljande besvär hos patienterna så som [3, 8, 21, 22]:
- tilltagande dyspné
- torrhosta
- fatigue
- undernäring
- nedstämdhet
- begränsad möjlighet till fysisk aktivitet och vardagsaktiviteter
- sänkt hälsorelaterad livskvalitet
- minskad förväntad livslängd.
Insatser utifrån interprofessionell samverkan är av stor vikt [2, 8, 23]. Tillsammans med patienten består teamet av:
- sjuksköterska
- läkare
- fysioterapeut
- arbetsterapeut
- dietist
- kurator.
Tidiga rehabiliteringsinsatser kan förbättra fysisk kapacitet, öka patientens livskvalitet, minska dyspné och öka förmåga till fysisk aktivitet och träning, samt arbetsförmåga. Kartläggning av patientens dagliga liv och energibesparande strategier kan öka delaktighet i personens dagliga aktiviteter, samt öka kunskap att hantera symptom som nedsatt ork och dyspné [2, 20, 22, 24-26]. Lindrande vård inklusive syrgasbehandling är aktuellt att adressera tidigt i förloppet. Syrgasbehandling kan ges vid aktivitet och/eller vila, se åtgärd (M) [23, 27].
Se åtgärd (H) rehabilitering och hälsofrämjande åtgärder, samt generisk modell för rehabilitering (pdf).
Lungfunktion
Sjukdomsprogress vid lungfibros kan monitoreras med olika tester [3]. Testerna görs vanligtvis vid diagnostillfället, var tredje till sjätte månad under första året, och upprepas var sjätte till tolfte månad eller tätare vid behov [3, 8]. Följande tester utförs för uppföljning och bedömning av sjukdomsprogression:
- forcerad vitalkapacitet (FVC) som bestäms vid dynamisk spirometri
- diffusionskapacitet för kolmonoxid korrigerat för aktuellt Hb-värde (DLCOc).
Absolut minskning av FVC ≥ 5 % och/eller DLCOc ≥ 10 % under ett år anses vara tecken på sjukdomsprogress [3].
Funktionell fysisk förmåga
Påverkan från fibrotiserande lungsjukdom på fysisk förmåga kan monitoreras med olika tester [8, 20, 26, 28]. Sex minuters gångtest (6MGT) görs vanligtvis vid diagnostillfället och upprepas var tredje till sjätte månad samt vid behov. Det genomförs med bedömning av desaturation samt skattning av dyspné och bentrötthet. Tillförlitlig metod för att mäta saturation (pulsoximeter och/eller prob) används utifrån patientens förutsättningar. Patientens förväntade förvärde i procent kan räknas ut för att bedöma den fysiska kapaciteten [29].
Testet 1-minute sit-to-stand (1STS) kan också användas för att bedöma den funktionella muskelstyrkan i nedre extremiteten [26, 28]. Det genomförs med bedömning av desaturation samt skattning av dyspné och bentrötthet. Liksom vid 6MGT går det att räkna ut procent av förväntat värde [30]. Det är viktigt att individuellt anpassa testen efter patientens behov och att välja det som patienten kan utföra.
För yngre patienter kan en ergospirometri vara ett bra alternativ av test av fysisk kapacitet för att identifiera lättare funktionsnedsättning i ett tidigt skede.
Exacerbationer
Akut exacerbation (AE) vid fibrotiserande lungsjukdom definieras som en försämring som börjat under de senaste 30 dagarna utan annan förklaring. Det är viktigt att utesluta andra tillstånd som förklaring till försämringen (exempelvis akut försämring av hjärtsvikt, infektioner och lungemboli) och behandla dessa [2, 3, 8, 27].
Hälsorelaterad livskvalitet (HRQL)
HRQL, mätt med sjukdomsspecifika frågeformulär, tenderar att vara sänkt hos personer med fibrotiserande lungsjukdom [2, 8, 21]. Bidragande orsaker är begränsningar i det sociala livet och begränsningar av fysisk aktivitet inklusive nedsatt arbetsförmåga. God förmåga till egenvård, kunskap om sjukdomen och behandlingar, aktivt deltagande i sin vård samt stöd från närstående är faktorer som kan bidra till stabil eller ökad HRQL.
I Sverige mäts HRQL främst med Kings korta frågeformulär för lungfibros (K-BILD) [31], se lungfibrosregistret (slmf.se).
Medelvärde vid diagnostillfället bland patienter med IPF, mätt med K-BILD, är 54 poäng, vilket är en måttligt sänkt HRQL.
Ingång och utgång
Ingång i vårdförloppet
Ingång i vårdförloppet sker:
- när en person uppvisar symtom (vanligen ansträngningsutlöst dyspné eller torrhosta) och kliniska fynd (krepitationer och/eller desaturation vid ansträngning) som kan vara förenliga med ILD med eller utan fibros, och där infektion (pågående eller postinfektiöst tillstånd), hjärtsjukdom (framför allt hjärtsvikt), astma, kroniskt obstruktiv lungsjukdom (KOL) och lungcancer, inte är primär misstanke.
- när en patient med autoimmun sjukdom uppvisar symtom eller undersökningsfynd som kan bero på ILD
- när ILD som upptäcks som bifynd vid radiologisk undersökning.
Ingång kan ske oavsett vårdnivå.
Utgång ur vårdförloppet
Utgång ur vårdförloppet sker:
- om utredning visar att lungfibros inte föreligger
- vid lungtransplantation.
Flödesschema för vårdförloppet
Flödesschemat i Figur 1 beskriver de åtgärder som ingår i vårdförloppet. Beskrivning i text finns i åtgärdstabellen.
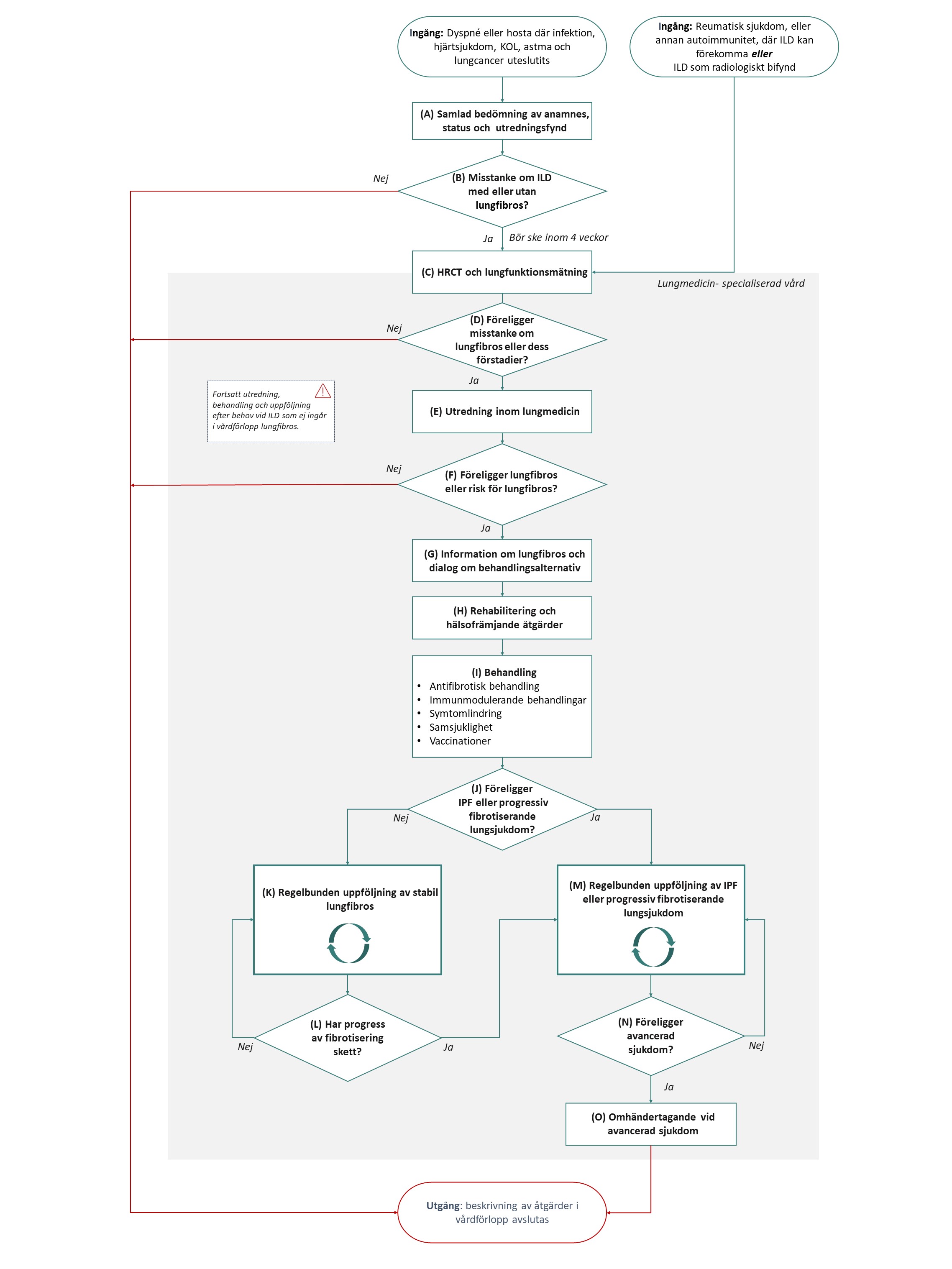
Vårdförloppets åtgärder
Här beskrivs de åtgärder som ingår i vårdförloppet.
A Samlad bedömning av anamnes, status och utredningsfynd
Hälso- och sjukvårdens åtgärder
Ta anamnes, status och inhämta utredningsfynd, följt av en samlad bedömning (se bilagor anamnes samt klinisk undersökning och utredning).
- Fördjupad anamnes innefattar:
a) dyspné
- förändring mot tidigare?
- persisterande i minst 8 veckor?
- vid ansträngning?
b) hosta
c) rökhistorik
d) exponering för dammpartiklar, organiskt eller oorganiskt
e) autoimmun sjukdom
f) läkemedelsbehandling
g) ärftlighet för lungsjukdom. - Beakta särskilt ålder och kön [1] samt om följande framkommer i status:
a) trumpinnefingrar
b) krepitationer vid lungaskultation
c) nedsatt perifer syresättning vid aktivitet eller i vila. - Beakta särskilt följande utredningsfynd:
a) Avvikande fynd från blodprovsanalys. Se bilaga klinisk undersökning och utredning
b) Restriktiv bild vid dynamisk och statisk spirometri. Är endast dynamisk spirometri utförd, och resultatet ger misstanke om ventilationsbegränsning med restriktiv bild, genomförs vidare utredning med statisk spirometri samt diffusionskapacitet
c) Resultat av lungröntgen. Det är av stor vikt att inte utesluta lungfibros även om lungröntgen inte visar tecken på det. Undersökningen har inte tillräcklig sensitivitet och specificitet
d) Mätning av desaturation vid aktivitet: sex minuters gångtest (6MGT) alternativt en minuts sit-to-stand test (1STS-test) [26, 28].
Fortsätt till (C) utan fördröjning när ingen misstanke om annan sjukdom finns, samt uppvisande av minst en av följande:
- slutinspiratoriska krepitationer (basalt och lateralt, bilateralt)
- radiologiskt fynd av fibrosförändringar
- sänkt FVC.
Genomför försäkringsmedicinsk bedömning och bedömning om behov av rehabiliteringsinsatser föreligger.
Patientens åtgärder (efter förmåga)
- skriva upp frågor i lugn och ro före besöket
- skriva ned svar under besöket
- eventuellt ha närstående med sig på besöket
- redogöra för sin sjukdomshistoria
- ställa frågor kring sina besvär
- vara observant och lyhörd kring svar på symtom som man söker för
- medverka i undersökningar
- delta i beslut om fortsatta undersökningar
- ta reda på hur rökstopp kan ske
efterfråga kontaktvägar till vårdgivare
B Beslut: Misstanke om ILD med eller utan lungfibros?
Hälso- och sjukvårdens åtgärder
Kvarstår misstanke efter att anamnes, status samt undersökningar är genomförda enligt (A)?
- Ja: fortsätt till åtgärd (C).
- Nej: fortsätt till utgång, beskrivning av åtgärder i vårdförlopp avslutas.
C HRCT och lungfunktionsmätning
Hälso- och sjukvårdens åtgärder
Åtgärden kan genomföras från olika vårdnivåer. Att det finns uttalade och fungerande rutiner inom regional och lokal sjukvårdsorganisation är fördelaktigt. Samma information som behövs till HRCT-remiss (se nedan) behöver också finnas tillgänglig för mottagaren av remissen till lungmedicinsk specialitet.
Säkerställ att lungmedicinsk specialitet tar ställning till patientfallet, företrädesvis genom att skicka remiss till lungmedicinsk specialitet med frågeställning ILD, lungfibros eller progressiv lungfibros.
- Beställ och genomför HRCT. Följande information ska ingå i remissen eller vara lätt tillgänglig enligt överenskomna rutiner.
- specifik frågeställning rörande ILD
- aktuell anamnes
- ålder
- kön
- rökhistorik
- eventuella samsjukligheter
- yrkesexponering/hereditet för ILD eller autoimmun sjukdom
- eventuellt bruk av läkemedel som kan ge lungpåverkan
- provsvar
- kliniska fynd från utredning och undersökning i (A)
- tidigare genomförda radiologiska undersökningar inklusive fynd.
HRCT-bilder [19] bedöms av thorax- /ILD-erfaren radiolog och svaret innehåller beskrivning av det mönster som eventuellt ses. En korrekt genomförd och granskad HRCT kan visa mönster som används i diagnosticering och uppföljning. Mönstren baseras huvudsakligen på följande morfologiska fynd:
- ”ground-glass”
- finretikulärt mönster
- traktionsbronkiol-, bronkiektasier
- cystor med bikakeutseende (så kallad ”honeycombing”).
De klassificeras sedan som:
- usual interstitial pneumonia (UIP), där följande alternativ finns:
- UIP
- trolig UIP
- obestämbart mönster
- alternativ diagnos
- non-specific interstitial pneumonia (NSIP)
- organizing pneumonia (OP).
- Beställ lungfunktionsmätning bestående av samtliga följande:
- dynamisk spirometri
- statisk spirometri
- diffusionskapacitet (inklusive Hb-korrigerat värde).
Säkerställ att rätt referensvärden väljs vid undersökning av lungfunktionen, och att undersökningen utförs på tekniskt korrekt sätt.
Informera och återkoppla till patient och närstående om resultat och planering
D Beslut: Föreligger misstanke om lungfibros eller dess förstadier?
Hälso- och sjukvårdens åtgärder
Föreligger misstanke om lungfibros eller dess förstadier?
- Ja: fortsätt till åtgärd (E).
- Nej: fortsätt till utgång, beskrivning av åtgärder i vårdförlopp avslutas. Vid oklarheter kan med fördel multidisciplinär konferens (MDK) konsulteras. Beakta att andra typer av ILD utreds och behandlas enligt gällande rekommendationer utifrån medicinsk diagnos. Exempelvis:
- kliniskt kunskapsstöd Sarkoidos, Nationellt kliniskt kunskapsstöd
- Vårdprogram för sarkoidos (https://slmf.se/kunskap/vardprogram-for-sarkoidos/)
- Diagnosis of Hypersensitivity Pneumonitis in Adults. An Official ATS/JRS/ALAT Clinical Practice Guideline. Publicerad i American journal of critical care medicine 2020.
E Utredning inom lungmedicin
Hälso- och sjukvårdens åtgärder
Utred grundligt dyspné, hosta och dess karaktär (se bilaga anamnes).
- komplettera anamnes inklusive frågeställning rörande autoimmunitet, exponeringar för dammpartiklar och läkemedel
- ta del av HRCT-resultat (ej äldre än 3 månader) med bedömning av ILD-erfaren radiolog
- ta del av resultat från lungfunktionsundersökning.
Utred och bedöm följande:
- lungauskultation (lyssna efter slutinspiratoriska krepitationer basalt och lateralt, bilateralt)
- basala blodprov
- autoantikroppar tas om orsaken till ILD inte är klar, inklusive:
- reumatoid faktor (RF)
- cyklisk citrullinerad peptid (CCP)
- anti nukleära antikroppar (ANA) med extraherbara nukleära antigen (ENA/specifik ANA)
- anti-neutrofila cytoplasmatiska antikroppar (ANCA)
- myositantikroppar (serologipanel med flertal myositautoantikroppar finns att beställa på alla svenska universitetssjukhus)
- risk för pulmonell hypertension
- syresättning i vila
- 6-minuters gångtest (6MGT)
- hälsorelaterad livskvalitet (HRQL)
- vikt och längd
- blodtryck
- kartlägg arbetsförmåga genom ett strukturerat instrument ”Dialog om arbetsförmåga” (DOA) [32] eller aktivitetsförmåga i dagliga livet genom strukturerat och validerat bedömningsinstrument förslagsvis ”COPM” eller ADL taxonomin [33, 34]
- gör en försäkringsmedicinsk bedömning efter att patientens funktions- och aktivitetsnivå samt rehabiliteringsbehov har bedömts. Se även Socialstyrelsens försäkringsmedicinska beslutsstöd samt åtgärd (H). Se Försäkringsmedicinskt beslutsstöd, Socialstyrelsen.
Säkerställ att patienten med närstående förstår given information.
Resultatet från HRCT-undersökningen ligger till grund för medicinsk diagnostik som sker av lungspecialist. Ta upp patientfallet i multidisciplinär konferens (MDK) om inte diagnos omgående kan fastställas.
Ytterligare undersökningar/åtgärder som kan rekommenderas från MDK:
- ultraljud av hjärtat (UKG)
- ergospirometri
- bronkoskopi med bronkoalveolärt lavage (BAL)
- biopsi.
Patientens åtgärder (efter förmåga)
Första besöket inom specialiserad vård:
- ställa frågor för att förstå sjukdomsförloppet
- informera sig om undersökningsresultat och om var i sjukdomsförloppet man befinner sig
- informera sig om fortsatt utredning och uppföljning
- informera sig om kontaktväg till sjuksköterska för stöd under utredningsprocess
- medverka i beslut om fortsatta undersökningar och/eller behandling.
F Beslut: Föreligger lungfibros eller risk för lungfibros?
Hälso- och sjukvårdens åtgärder
Föreligger lungfibros, eller risk för att det kan uppstå, efter genomförda undersökningar och bedömningar enligt åtgärd (E)?
- Ja: fortsätt till åtgärd (G).
- Nej: annan diagnos är mer sannolik som förklaring till att symtom föreligger. Fortsätt till utgång, beskrivning av åtgärder i vårdförlopp avslutas. Det bör noteras att annan ILD också kan vara mycket allvarlig och leda till grav lungfunktionsförlust, syrgasbehov och behov av lungtransplantation. Detta kan kräva omfattande lungmedicinsk utredning, behandling, multidisciplinär konferens (MDK), samt rehabiliteringsbehov och insatser av sjukvårdspersonal, i likhet med vad som beskrivs i detta vårdförlopp.
G Information om lungfibros och dialog om behandlingsalternativ
Hälso- och sjukvårdens åtgärder
- ge diagnosbesked snarast möjligt
- tillse att patient och närstående förstår undersökningsresultat
- tillse att patient och närstående förstår sjukdomen och prognos, även om specifik diagnos inte har kunnat fastställas ännu
- genomför samtal vid allvarlig sjukdom med patient, och med patientens medgivande även närstående. Se Vårdförlopp Palliativ vård, Nationellt kliniskt kunskapsstöd åtgärd (B). Patient och närstående ges möjlighet att uttrycka sina egna behov och önskemål. Samtal bör innefatta:
- dialog om möjligt sjukdomsförlopp
- allmän prognos
- behandlingsintentioner
- tillse att patienten har, och förstår, information om rehabilitering, egenvårdsstrategier, levnadsvanor och dess effekter. Se åtgärd (H)
- ge information om hur eventuell läkemedelsbehandling sker och vem i det interprofessionella teamet som patienten har som primär kontakt rörande behandling och dess eventuella biverkningar. Se åtgärd (I)
- ge kontaktuppgifter till fast vårdkontakt
- kom överens med patienten när och med vem nästa planerade vårdkontakt sker
- tillse att patienten vet i vilka situationer hen tar oplanerad kontakt (exempelvis försämring av symtom).
Ge information om lungtransplantation:
- gå igenom indikationer och kontraindikationer i tidigt stadium
- ta ställning till utredning i samband med diagnos och därefter vid varje uppföljning.
Ta ställning till behandling vid akut exacerbation (AE). Diskutera och bestäm i tidigt skede vilken behandlingsnivå som ska gälla vid AE. Ställningstagande sker på individuell nivå eftersom förloppet kan vara mycket snabbt. Ställningstagande görs till:
- sjukhusinläggning
- non invasiv ventilation (NIV)
- högflödesbehandling (HFNC)
- intensivvård (IVA) och respiratorvård.
Ta fram en individuell vårdplan tillsammans med patienten och eventuella närstående. Rehabiliteringsplan med interventioner, mål, delmål och plan för uppföljning upprättas vid inskränkning i utförande av vardagliga aktiviteter eller annat behov av rehabilitering, även när detta framkommer i tidig utredning och bedömning. Rehabiliteringsplanen är en del av den individuella vårdplanen.
Patientens åtgärder (efter förmåga)
- hålla sig uppdaterad, vara lyhörd och ställa frågor för att förstå
- överväga second opinion om förtroendet sviktar
- delta i dialog om behandlingsalternativ
- medverka i framtagande av vårdplan
- involvera närstående vid behov.
H Rehabilitering och hälsofrämjande åtgärder
Hälso- och sjukvårdens åtgärder
Använd interprofessionell samverkan där sjuksköterska, läkare, fysioterapeut, dietist, arbetsterapeut och kurator ingår. Kontakta kommunens hemsjukvård om behov föreligger.
Ge information om att stöd från vården finns i form av:
- fysisk aktivitet/träning
- utbildning i andningstekniker inklusive slemmobilisering
- psykosocialt stöd och behandling vid behov
- kostrådgivning
- utbildningsinsatser från olika professioner
- stöd att hitta strategier för att få vardagen att fungera
- energibesparing och hjälpmedel för att möjliggöra:
- aktiviteter i det dagliga livet, exempelvis andningsteknik
- förskrivning av hjälpmedel
- generella energibesparande strategier såsom att sitta ner, i stället för att stå, när aktiviteter utförs.
Planera och upprätta individuell rehabiliteringsplan, som utifrån personens behov kan ingå i den individuella vårdplanen.
Genomför åtgärder enligt rehabiliteringsplan.
Bedöm fysisk funktionell förmåga och arbetsförmåga [26, 32-34].
Bedöm HRQL med sjukdomsspecifikt verktyg, K-BILD rekommenderas [8, 31], var 3-6 månad.
Ge information om patientföreningen för lungfibros.
Ge information och återkoppling till patient och närstående om när och hur nästa planerade kontakt med vården sker.
Patientens åtgärder (efter förmåga)
- medverka i beslut om stöd och behandling
- delta i samverkan med specialiserad profession, individuellt eller i grupp
- medverka i överenskommen rehabiliteringsplan.
I Behandling
Hälso- och sjukvårdens åtgärder
Vid svår obestämd typ av fibrotiserande lungsjukdom, där det inte finns vetenskapligt eller beprövat behandlingsförslag, bör behandlingsbeslut tas inom MDK. Specifika behandlingar bör diskuteras och ges i samråd med relevanta medicinska specialiteter. Utvärdering av all medicinering bör ske kontinuerligt och justering eller utsättning ske när nackdelar överväger nyttan. Nya behandlingar vid lungfibros kan förväntas inom de närmsta åren.
Antifibrotisk behandling
Använd nintedanib och pirfenidon enligt godkänd indikation:
- nintedanib och pirfenidon har indikation för behandling av IPF. Behandling vid IPF ges enligt Vårdprogram IPF, SLMF [8]
- nintedanib har även indikation vid progressiv lungfibros (PPF) samt systemisk skleros (SSc)-associerad ILD.
I FASS finns information om pirfenidon och nintedanib.
Nya läkemedel och indikationer förväntas komma eftersom studier pågår om nya antifibrotiska läkemedel.
Var tydlig i den interprofessionella samverkan vem som har vilket ansvar i behandlingens olika delar:
- genomför patientutbildning om läkemedlet inklusive verkan, eventuella biverkningar och uppföljningar
- kom överens i dialog med patient om när och hur uppföljning av behandling sker
- genomför kontrollblodprover före och under behandling
- skriftlig information om blodprovstagningschema lämnas till patienten
- utför uppföljning och hantering av biverkningar:
- biverkan kan vara upplevd (subjektiv) och/eller objektiv
- genomför biverkanskontroll samt administrationskontroll (att och hur överenskommen dos tas)
- återkoppla till patienten samma dag (alternativt nästkommande vardag) hur hantering av biverkningar ska ske inklusive eventuella dosjusteringar.
Immunmodulerande behandlingar
Immunmodulerande läkemedel används vanligen som förstahandsbehandling om det finns misstanke om inflammationsdriven sjukdom. Vanligt är:
- glukokortikosteroider
- immunsuppressiva läkemedel.
Samarbeta mellan lungmedicin och reumatologi vid behandling av patienter med lungfibros och reumatisk sjukdom, företrädesvis genom MDK.
Svensk reumatologisk förening har på sin hemsida under respektive reumatisk sjukdom riktlinjer för behandlingsrekommendationer.
Bedöm behovet av immunmodulerande behandling med regelbundna intervaller, se åtgärd (K) och (M). Behandla efter symtom och objektiva fynd.
Annan symtomlindring
- slemlösande läkemedel
- hostdämpande läkemedel
- medicinering mot dyspné.
Samsjuklighet
Behandla andra samtidiga sjukdomar enligt etablerade riktlinjer.
Vaccinationer
Erbjud och kommunicera vikten av:
- årlig influensavaccination
- pneumokockvaccination enligt nationella rekommendationer
- covid-19-vaccination enligt nationella rekommendationer
- övriga vaccinationer enligt gällande nationella rekommendationer.
Patientens åtgärder (efter förmåga)
- förbereda sig inför återbesök, inklusive ha förberedda frågor
- ifrågasätta behandlingsstrategi om man inte håller med eller inte förstår resonemanget
- medverka i beslut om fortsatt behandling
- delta i patientutbildning om läkemedel
- förmedla eventuella biverkningar av läkemedelsbehandling.
J Beslut: Föreligger IPF eller progressiv fibrotiserande lungsjukdom?
Hälso- och sjukvårdens åtgärder
Föreligger IPF eller progressiv fibrotiserande lungsjukdom?
- Ja: fortsätt till åtgärd (M).
- Nej: fortsätt till åtgärd (K).
K Regelbunden uppföljning vid stabil lungfibros
Hälso- och sjukvårdens åtgärder
Genomför uppföljning enligt individuell vårdplan inklusive rehabilitering, se åtgärd (H). Årlig uppföljning rekommenderas generellt [3].
Stäm av och vid behov uppdatera individuell vårdplan tillsammans med patienten efter varje uppföljning.
Progress av lungfibros definieras som minst två av följande tre kriterier [3]:
- progress av fibrotisering enligt HRCT-bild (en eller flera):
- ökning av traktionsbronkiektasier
- nytillkommen ”ground glass” med traktionsbronkiektasier
- nytillkommet finretikulärt mönster
- ökning av retikulära förändringar
- nytillkommet eller ökat bikakemönster
- minskade lungvolymer
- försämring av lungfunktionsvärden (en eller båda):
- absolut minskning av FVC ≥ 5 % av förväntat under ett år
- absolut minskning av DLCO (Hb-korrigerat) ≥ 10 % av förväntat under ett år
- symtomprogress.
L Beslut: Har progress av fibrotisering skett?
Hälso- och sjukvårdens åtgärder
Har progress av fibrotisering skett?
- Ja: fortsätt till åtgärd (M).
- Nej: fortsätt tillbaka till (K) enligt individuell vårdplan om tillståndet är stabilt utan tecken på progress av fibrotisering.
M Regelbunden uppföljning av IPF eller progressiv fibrotiserande lungsjukdom
Hälso- och sjukvårdens åtgärder
Medicinsk bedömning utförs av, eller i samråd med, lungspecialist.
Genomför uppföljning med klinisk bedömning, var 3:e till 6:e månad (individuell bedömning) under det första året (därefter var 6:e till 12:e månad, eller oftare, efter behov), som innefattar:
- lungfunktionsundersökning
- bedömning av fysik funktion, exempelvis 6MGT
- skattning av HRQL med hjälp av K-BILD
- mätning av kroppsvikt
- bedömning av behov av, eller uppföljning av, läkemedelsbehandling. Se åtgärd (I)
- utifrån medicinsk bedömning och individens behov: HRCT, UKG
- försäkringsmedicinsk bedömning
- utvärdering av lungrehabilitering och samverkande insatser. Se åtgärd (H)
- bedöm behov av fortsatt samtal vid allvarlig sjukdom, även med närstående om patienten samtycker. Patient och närstående ges möjlighet att uttrycka sina egna behov och önskemål. Samtal bör innefatta:
- dialog om möjligt sjukdomsförlopp
- allmän prognos
- behandlingsintentioner
- bedömning av vårdbegränsningar, brytpunktssamtal och palliativa insatser
- uppdatering av individuell vårdplan, inklusive rehabiliteringsplan, tillsammans med patient.
Handläggning vid försämringsepisoder
Behandla eventuella bakomliggande orsaker till försämringen så som:
- infektioner
- lungemboli
- pneumothorax
- hjärtsvikt
- pulmonell hypertension.
Syrgasbehandling
Enligt gällande riktlinjer för Oxygen, Swedevox.
Patientens åtgärder (efter förmåga)
- redogöra för sitt hälsoläge
- ge synpunkter på behandling
- medverka i diskussion och beslut om behandling
- fråga och ifrågasätta om man inte håller med eller inte förstår resonemang
- följa den överenskomna vårdplanen
- medverka i uppdatering av vårdplanen.
N Beslut: Föreligger avancerad sjukdom?
Hälso- och sjukvårdens åtgärder
Föreligger avancerad sjukdom? Med avancerad sjukdom avses snabb progress och/eller svår organpåverkan med överhängande risk för fortsatt försämring, kraftig symtombörda och död.
- Ja: fortsätt till åtgärd (O).
- Nej: fortsätt tillbaka till (M).
O Omhändertagande vid avancerad sjukdom
Hälso- och sjukvårdens åtgärder
Behandlingsnivå vid en akut exacerbation samt annan försämring bör diskuteras och bestämmas i tidigt skede på individuell nivå eftersom förloppet kan vara mycket snabbt, se åtgärd (G).
Ta ställning till:
- fortsatt antifibrotisk behandling
- symtomlindrande behandling
- start av eller ökad syrgasbehandling
- fortsatt planering för palliativ vård i livets slutskede enligt palliativt vårdförlopp, Nationellt kliniskt kunskapsstöd.
Det kan även komma att innefatta:
- dialog rörande kvarvarande möjlighet till lungtransplantation
- uppföljning av HRQL
- remiss till specialiserad palliativ vård.
Patientens åtgärder (efter förmåga)
- delta i beslut
- be om upprepad muntlig information
- be om skriftlig information
- involvera närstående vid behov.
Patientmedverkan och kommunikation
Personcentrering och dokumenterad överenskommelse
Personcentrering är beaktad i ovan beskrivna åtgärder genom att det är skrivet ur den drabbade patientens synvinkel och i varje del med den drabbade personens berättelse som grund. Utöver detta är nedanstående viktigt att lyfta fram.
Dokumenterad överenskommelse/patientkontrakt utformas gemensamt av patienten och dess fasta vårdkontakt och är en överenskommelse om planerad uppföljning, behandling samt kontaktuppgifter till vården. Det framgår också vem som är patientens fasta vårdkontakt. Där framgår när patienten kan förvänta sig nästa kontakt (utifrån personens behov) samt vid vilka symtom patienten ska höra av sig till vården och vart patienten kan vända sig. Det ska vara tydligt vilka åtgärder som vården ansvarar för och vad patienten själv kan göra. Det framgår även vilket stöd patienten kan få i form av interprofessionell samverkan samt vilka möjligheter till behandling som finns och vilka effekter, önskade och oönskade, dessa kan innebära. Patientkontraktet följs upp enligt åtgärder i detta vårdförlopp.
Utmaningar och mål
Patientens utmaningar
Utifrån patienters och närståendes erfarenheter har följande övergripande utmaningar identifierats:
- lång tid till påbörjad utredning av lungfibros
- avsaknad av personcentrerad vård och begriplig information under utredning och diagnostisering
- ojämlik vård
- lång tid till diagnosticering och behandling
- sänkt livskvalitet.
Nulägesbeskrivning av patienters erfarenheter
Figur 2 nedan är en grafisk presentation av i nuläget vanligt förekommande erfarenheter av hälso- och sjukvården hos vuxna med lungfibros.
- I kolumn 1 beskrivs identifierade positiva och negativa patientupplevelser.
- I kolumn 2 anges för patienten vanligt förkommande aktiviteter och åtgärder.
- I kolumn 3 beskrivs vårdens vanligt förekommande aktiviteter och åtgärder.
- I kolumn 4 beskrivs huvudsakliga utmaningar som patienten möter. Vårdförloppet är utformat för att adressera dessa utmaningar som även avspeglas i vårdförloppets mål och indikatorer.

Vårdförloppets mål
Vårdförloppets mål är att:
- Patienten genomgår en aktiv och skyndsam utredning tills orsaken till patientens initiala symtom har fastställts.
- Patientfallet tas upp på Multidisciplinär konferens (MDK):
- när läkare inom lungmedicinsk specialiserad vård, med stöd av thoraxradiologs utlåtande, inte kan fastställa diagnos
- om osäkerhet kring behandling föreligger
- för att säkerställa att en tydlig planering för vidare utredning och åtgärder finns, särskilt i de fall när diagnosticering är komplicerad.
- Patienten har tillgång till kontaktperson, kontinuerlig information, stöd och utbildning utifrån utredning, diagnos, behandling, rehabilitering i interprofessionell samverkan, hälsofrämjande åtgärder samt uppföljning och palliativ vård när behov uppstår.
Kvalitetsuppföljning
Vårdförloppets indikatorer presenteras här och i bilagan Uppföljning av vårdförlopp lungfibros finns mer information om uppföljning av vårdförloppet och dess indikatorer.
Läs mer om uppföljning av vårdförlopp under rubriken Generellt om personcentrerade och sammanhållna vårdförlopp.
Indikatorer för uppföljning
Resultatmått
- Andel patienter med IPF eller PPF med stabil eller ökad HRQL mätt med Kings korta frågeformulär för lungfibros (K-BILD) under 6 månader (andel utan minskning av totalpoäng ≥5)
- Andel patienter med IPF eller PPF med bibehållen eller ökad (≥30 meter) gångsträcka vid 6 minuters gångtest under 6 månader.
Processmått
- Genomsnittligt antal dagar från senaste utförda HRCT till diagnos för patienter med IPF eller PPF
- Genomsnittligt antal dagar till försämrad (minskad totalpoäng ≥5) HRQL, mätt med K-BILD beräknat från datum för diagnos för patienter med IPF eller PPF
- Genomsnittligt antal dagar till försämrad gångsträcka (minskad ≥30 meter) vid 6 minuters gångtest beräknat från datum för diagnos för patienter med IPF eller PPF
- Andel patienter som vid vårdkontakt får diagnosen IPF eller PPF för första gången och samtidigt får undersökningarna, 6 minuters gångtest, lungfunktion och sjukdomsspecifik HRQL
- Andel patienter med diagnosen IPF eller PPF som fått patientutbildning inom 12 månader från diagnos
- Andel patienter med diagnosen IPF eller PPF som fått en vårdplan inom 3 månader från diagnos
Bilaga Lungfibros vardforlopp.pdf
Kvalitetsregister
Följande kvalitetsregister kan vara relevanta att registrera i under någon del av vårdförloppet (se även åtgärdsbeskrivningen) oavsett om de används för uppföljning av vårdförloppets indikatorer eller inte.
Lungfibrosregistret samlar sedan 2014 information om personer med IPF i hela Sverige. Täckningsgrad är cirka 65 %. Resultatmått för gångsträcka (6MGT), lungfunktion samt HRQL (mätt med K-BILD) är exempel på mått som kan fås från registret. Det finns möjlighet att utöka registret till att inkludera alla personer med lungfibros.
Sammanfattning av vårdförloppet
Lungfibros är ett samlingsbegrepp för tillstånd med ärromvandling av lungvävnad och ingår bland de interstitiella lungsjukdomarna (interstitial lung diseases, ILDs). Diagnosticering av lungfibros baseras i första hand på radiologiskt mönster från högupplöst datortomografi (high resolution computed tomography, HRCT) tillsammans med den kliniska bilden (anamnes, status samt förlopp). ILD, och särskilt lungfibros, är ovanliga tillstånd, inte fler än ungefär 70 av 100 000 personer drabbas. Tillstånd som kan likna ILD-sjukdom med eller utan lungfibros är reflux, astma, kronisk obstruktiv lungsjukdom (KOL), hjärtsvikt, ångest samt post-infektiöst tillstånd.
Lungfibros i form av progressiv fibrotiserande lungsjukdom orsakar en kontinuerlig förlust av lungfunktion med påföljande besvär så som tilltagande dyspné, torrhosta, fatigue, undernäring, nedstämdhet, begränsad möjlighet till aktivitet, sänkt hälsorelaterad livskvalitet och minskad förväntad livslängd.
Vårdförloppet omfattar vuxna personer med lungfibros och inleds när en person uppvisar ansträngningsutlöst dyspné eller torrhosta samt krepitationer eller desaturation vid ansträngning och där infektion, hjärtsjukdom, astma, KOL och lungcancer uteslutits. Vårdförloppet kan även inledas genom att en patient med autoimmun sjukdom uppvisar symtom eller undersökningsfynd som kan bero på ILD, eller när ILD upptäcks som bifynd vid radiologisk undersökning. Åtgärderna avslutas om misstanke om lungfibros avskrivs eller om personen genomgår lungtransplantation.
Målet med vårdförloppet är att personer med lungfibros får möjlighet till utredning, behandling och omhändertagande utan onödiga dröjsmål. Målen är även att de får tillgång till kontaktperson, kontinuerlig information, stöd, utbildning, behandling, rehabilitering i interprofessionell samverkan, samt uppföljning och palliativ vård när behov uppstår. Uppföljning av vårdförloppet sker genom resultat- och processmått.
Vårdförloppet beskriver de åtgärder som utförs från den initiala utredningen, via djupare utredning efter stärkt misstanke om lungfibros, till diagnosticering, behandling och omhändertagande. Även skillnad i åtgärder vid stabil respektive progressiv sjukdom beskrivs.
Generellt om personcentrerade och sammanhållna vårdförlopp
Om vårdförlopp
Personcentrerade och sammanhållna vårdförlopp syftar till att uppnå ökad jämlikhet, effektivitet och kvalitet i hälso- och sjukvården samt att skapa en mer välorganiserad och helhetsorienterad process för patienten.
Vårdförloppen utgår från tillförlitliga och aktuella kunskapsstöd och tas gemensamt fram av olika professioner inom regionernas nationella system för kunskapsstyrning.
I vårdförloppet beskrivs kortfattat vad som ska göras, i vilken ordning och när. Det beskriver en personcentrerad och sammanhållen vårdprocess som omfattar en hel eller en del av en vårdkedja. Åtgärderna kan individanpassas och inkluderar hur individens hälsa kan främjas.
Vårdförloppen avser minska oönskad variation och extra fokus riktas till det som inte fungerar i nuläget ur ett patientperspektiv. Det personcentrerade förhållnings- och arbetssättet konkretiseras genom patientkontrakt som tillämpas i vårdförloppen.
Den primära målgruppen för kunskapsstödet är hälso- och sjukvårdspersonal som ska få stöd i samband med vårdmötet. Avsnitten som rör utmaningar, mål och uppföljning av vårdförloppet är främst avsedda att användas tillsammans med beskrivningen av vårdförloppet vid införande, verksamhetsutveckling och uppföljning. De riktar sig därmed till en bredare målgrupp.
Om personcentrering
Ett personcentrerat förhållnings- och arbetssätt konkretiseras genom patientkontrakt, som är en gemensam överenskommelse mellan vården och patienten om fortsatt vård och behandling.
Patientkontraktet utgår från patientens och närståendes behov, resurser och erfarenheter av hälso- och sjukvård och innebär att en eller flera fasta vårdkontakter utses samt att det framgår vad vården tar ansvar för och vad patienten kan göra själv.
Patientkontrakt kan göras vid flera tillfällen, relaterat till patientens hälsotillstånd.
Mer information finns på SKR:s webbsida om patientkontrakt.
Om kvalitetsuppföljning
Vårdförloppen innehåller indikatorer för att följa upp i vilken grad patienten har fått vård enligt vårdförloppet. Befintliga källor används i den mån det går, men målsättningen är att strukturerad vårdinformation ska utgöra grunden för kvalitetsuppföljningen. Kvalitetsuppföljningen ska så stor utsträckning som möjligt baseras på information som är relevant för vården av patienten.
Vårdförloppets mål och åtgärder följs upp genom resultat- och processmått, vilket skapar förutsättningar för ett kontinuerligt förbättringsarbete.
För detaljerad information om hur indikatorerna beräknas, hänvisas till webbplatsen Kvalitetsindikatorkatalog där kompletta specifikationer publiceras i takt med att de är genomarbetade. Där beskrivs och motiveras också de valda indikatorerna.
Indikatorerna redovisas på Vården i siffror vartefter data finns tillgängligt. Data redovisas könsuppdelat och totalt, och för både region- och enhetsnivå när det är möjligt och relevant.
Relaterad information
Kompletterande underlag
Referenser
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383(10):958-68.
- Wijsenbeek M, Suzuki A, Maher TM. Interstitial lung diseases. Lancet. 2022;400(10354):769-86.
- Raghu G, Remy-Jardin M, Richeldi L, Thomson CC, Inoue Y, Johkoh T, et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2022;205(9):e18-e47.
- Spagnolo P, Ryerson CJ, Putman R, Oldham J, Salisbury M, Sverzellati N, et al. Early diagnosis of fibrotic interstitial lung disease: challenges and opportunities. Lancet Respir Med. 2021;9(9):1065-76.
- Joy GM, Arbiv OA, Wong CK, Lok SD, Adderley NA, Dobosz KM, et al. Prevalence, imaging patterns and risk factors of interstitial lung disease in connective tissue disease: a systematic review and meta-analysis. Eur Respir Rev. 2023;32(167).
- Graney BA, Fischer A. Interstitial Pneumonia with Autoimmune Features. Ann Am Thorac Soc. 2019;16(5):525-33.
- Rajan SK, Cottin V, Dhar R, Danoff S, Flaherty KR, Brown KK, et al. Progressive pulmonary fibrosis: an expert group consensus statement. Eur Respir J. 2023;61(3).
- Sköld M (red). Idiopatisk lungfibros. Vårdprogram. Göteborg: Mediahuset/Svensk lungmedicinsk förening; 2019.
- Kreuter M, Picker N, Schwarzkopf L, Baumann S, Cerani A, Postema R, et al. Epidemiology, healthcare utilization, and related costs among patients with IPF: results from a German claims database analysis. Respir Res. 2022;23(1):62.
- Podolanczuk AJ, Thomson CC, Remy-Jardin M, Richeldi L, Martinez FJ, Kolb M, et al. Idiopathic pulmonary fibrosis: state of the art for 2023. Eur Respir J. 2023;61(4).
- Ferrara G, Arnheim-Dahlström L, Bartley K, Janson C, Kirchgässler K-U, Levine A, et al. Epidemiology of Pulmonary Fibrosis: A Cohort Study Using Healthcare Data in Sweden. 2019;5(1):55-68.
- Perelas A, Silver RM, Arrossi AV, Highland KB. Systemic sclerosis-associated interstitial lung disease. Lancet Respir Med. 2020;8(3):304-20.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236-45.
- Lescoat A, Huscher D, Schoof N, Airò P, de Vries-Bouwstra J, Riemekasten G, et al. Systemic sclerosis-associated interstitial lung disease in the EUSTAR database: analysis by region. Rheumatology (Oxford). 2023;62(6):2178-88.
- Raghu G, Chen SY, Hou Q, Yeh WS, Collard HR. Incidence and prevalence of idiopathic pulmonary fibrosis in US adults 18-64 years old. Eur Respir J. 2016;48(1):179-86.
- Distler O, Assassi S, Cottin V, Cutolo M, Danoff SK, Denton CP, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55(5).
- Meyer KC. Pulmonary fibrosis, part I: epidemiology, pathogenesis, and diagnosis. Expert Rev Respir Med. 2017;11(5):343-59.
- Borie R, Kannengiesser C, Antoniou K, Bonella F, Crestani B, Fabre A, et al. European Respiratory Society statement on familial pulmonary fibrosis. Eur Respir J. 2023;61(3).
- Cottin V, Valenzuela C. Diagnostic approach of fibrosing interstitial lung diseases of unknown origin. Presse Med. 2020;49(2):104021.
- Dowman L, Hill CJ, May A, Holland AE. Pulmonary rehabilitation for interstitial lung disease. Cochrane Database Syst Rev. 2021;2(2):Cd006322.
- Overgaard D, Kaldan G, Marsaa K, Nielsen TL, Shaker SB, Egerod I. The lived experience with idiopathic pulmonary fibrosis: a qualitative study. The European respiratory journal. 2016;47(5):1472.
- Nolan CM, Polgar O, Schofield SJ, Patel S, Barker RE, Walsh JA, et al. Pulmonary Rehabilitation in Idiopathic Pulmonary Fibrosis and COPD: A Propensity-Matched Real-World Study. Chest. 2022;161(3):728-37.
- Lindell KO, Klein SJ, Veatch MS, Gibson KF, Kass DJ, Nouraie M, et al. Nurse-Led Palliative Care Clinical Trial Improves Knowledge and Preparedness in Caregivers of Patients with Idiopathic Pulmonary Fibrosis. Ann Am Thorac Soc. 2021;18(11):1811-21.
- Kataoka K, Nishiyama O, Ogura T, Mori Y, Kozu R, Arizono S, et al. Long-term effect of pulmonary rehabilitation in idiopathic pulmonary fibrosis: a randomised controlled trial. Thorax. 2023;78(8):784-91.
- Nakazawa A, Dowman LM, Cox NS, Brazzale DJ, McDonald CF, Hill CJ, et al. Prescribing walking training in interstitial lung disease from the 6-minute walk test. Physiother Theory Pract. 2023;39(4):873-7.
- Holland AE, Spruit MA, Troosters T, Puhan MA, Pepin V, Saey D, et al. An official European Respiratory Society/American Thoracic Society technical standard: field walking tests in chronic respiratory disease. Eur Respir J. 2014;44(6):1428-46.
- Collard HR, Ryerson CJ, Corte TJ, Jenkins G, Kondoh Y, Lederer DJ, et al. Acute Exacerbation of Idiopathic Pulmonary Fibrosis. An International Working Group Report. Am J Respir Crit Care Med. 2016;194(3):265-75.
- Oishi K, Matsunaga K, Asami-Noyama M, Yamamoto T, Hisamoto Y, Fujii T, et al. The 1-minute sit-to-stand test to detect desaturation during 6-minute walk test in interstitial lung disease. NPJ Prim Care Respir Med. 2022;32(1):5.
- Enright, P. L. & Sherrill, D. L. Reference equations for the six-minute walk in healthy adults. Am J Respir Crit Care Med 158, 1384-1387 (1998).
- Strassmann, A. et al. Population-based reference values for the 1-min sit-to-stand test. Int J Public Health 58, 949-953 (2013).
- Wapenaar M, Patel AS, Birring SS, Domburg RTV, Bakker EW, Vindigni V, et al. Translation and validation of the King’s Brief Interstitial Lung Disease (K-BILD) questionnaire in French, Italian, Swedish, and Dutch. Chron Respir Dis. 2017;14(2):140-50.
- Norrby E, Lindahl I. Dialog om arbetsförmåga (DOA), version 5.0 inklusive DOA-lättläst. Sveriges arbetsterapeuter. 2023.
- McColl MA, Denis CB, Douglas KL, Gilmour J, Haveman N, Petersen M, et al. A Clinically Significant Difference on the COPM: A Review. Can J Occup Ther. 2023;90(1):92-102.
- Tornquist K, Sonn U. ADL-Taxonomin® - en bedömning av aktivitetsförmåga. Sveriges arbetsterapeuter. 2022.
- Borie R, Kannengiesser C, Antoniou K, Bonella F, Crestani B, Fabre A et.al. European Respiratory Society statement on familial pulmonary fibrosis. Eur Respir J. 2023 Mar 16;61(3):2201383. Doi: 10.1183/13993003.01383-2022. PMID: 36549714
- Hunninghake GM, Goldin JG, Kadoch MA, Kropski JA, Rosas IO, Wells AU, et al.; ILA Study Group. Detection and Early Referral of Patients With Interstitial Lung Abnormalities: An Expert Survey Initiative. Chest. 2022;161(2):470-482.
Konsekvensbeskrivning
Bilagor
Bilaga 1– Kompletterande bakgrund om interstitiell lungsjukdom (ILD). VF Lungfibros.pdf
Bilaga 2 – Autoimmun sjukdom . VF Lungfibros. docx.pdf
Bilaga 3 – Interstitiella lungabnormaliteter (ILA) VF Lungfibros. docx.pdf
Bilaga 4 – Anamnes. VF Lungfibros. docx.pdf
Bilaga 5 – Klinisk undersökning och utredning. VF Lungfibros. docx.pdf